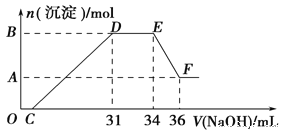
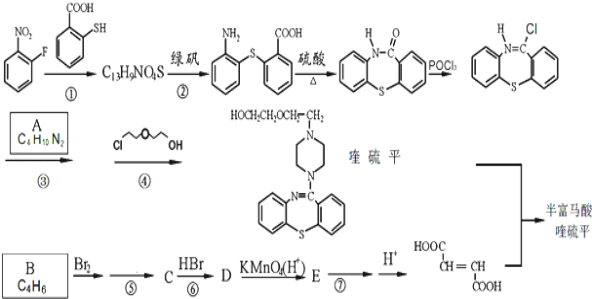
题目内容
【题目】氯化铁溶液与氢氧化铁胶体的共同点是 ( )
A.分散质颗粒直径都在l~100nm之间
B.用一束平行光照射时,从侧面都可以看到一束光束
C.颜色都呈红褐色
D.都是分散系
【答案】D
【解析】
A. 氯化铁溶液分散质颗粒直径小于1nm,氢氧化铁胶体分散质颗粒直径在l~100nm之间,错误;
B. 用一束平行光照射时,只有氢氧化铁胶体从侧面可以看到一束光束,错误;
C. 氯化铁溶液是棕黄色的,氢氧化铁胶体颜色呈红褐色,错误;
D. 溶液和胶体都是分散系,正确;
故选D。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_______(用离子符号表达)。
(2)W的最简单氢化物的电子式为______。
(3)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为:________。Y的最高价氧化物与Z的气态氢化物的水溶液反应的离子方程式:__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
【题目】键能的大小可用于计算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g)= 2HCl(g)过程中,当生成1molHCl气体时需要___(填“吸收”或“放出” )____kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___kJ·mol-1。
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______(用含ΔH1、ΔH2、ΔH3的式子表示)。