题目内容
19.利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | 甲 | 乙 | 丙 | 实验结论 | 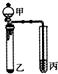 |
| A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:碳>硅 | |
| B | 双氧水 | MnO2 | Na2S | 氧化性:H2O2>O2>S | |
| C | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液 | SO2具有漂白性 | |
| D | 浓氨水 | 氢氧化钠固体 | 酚酞 | 碱性:NaOH>NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸易挥发;
B.氧化剂的氧化性大于氧化产物;
C.SO2具有还原性,能被KMnO4氧化;
D.氢氧化钠固体易潮解,溶于水放热.
解答 解:A.浓盐酸易挥发,应将氯化氢除掉后再通入Na2SiO3溶液,故A错误;
B.双氧水分解生成氧气,氧气与硫化钠反应生成硫单质,根据氧化剂的氧化性大于氧化产物,说明氧化性:H2O2>O2>S,故B正确;
C.因SO2具有还原性,能被KMnO4氧化,则将SO2通入酸性KMnO4溶液中,溶液褪色,可说明SO2具有还原性,故C错误;
D.氢氧化钠固体易潮解,溶于水放热,使氨气挥发,与碱性无关,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备与性质等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列对于混合气体的描述,正确的是(NA为阿伏伽德罗常数)
| A. | 分子数为NA的CO和N2的混合气体体积为22.4L,平均相对分子质量为28 | |
| B. | 体积不变的容器中进行的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,随着反应的进行气体密度逐渐减小 | |
| C. | Na2O2和NH4Cl浓溶液反应得到混合气体的平均相对分子质量可能是34 | |
| D. | 对于反应I2(g)+H2(g)$\stackrel{△}{?}$2HI(g)而言,达到平衡后,气体的平均相对分子质量不变 |
9.如图图示与对应的叙述相符的是( )


| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
4.某温度下,0.021mol•L-1NaHSO3溶液的pH约为3.下列有关说法中正确的是( )
| A. | c(HSO3-)+2c(SO32-)+c(H2SO3)=0.021mol•L-1 | |
| B. | c(OH-)+c(SO32-)=c(H2SO3)+c(HSO3-) | |
| C. | $\frac{c({H}^{+})•c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$约为5×10-5 | |
| D. | 加水稀释10倍后,溶液的pH=4 |
11.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
8.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 短周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
9.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | NH4Cl→NH3↑+HCl↑ | B. | NH3+CO2+H2O→NH4HCO3 | ||
| C. | 2NaOH+Cl2→NaCl+NaClO+H2O | D. | 2Na2O2+2CO2→2Na2CO3+O2 |

 +2CH2=C(CH3)2→
+2CH2=C(CH3)2→