题目内容
2.设NA为阿付加德罗常数的值,下列说法正确的是( )| A. | 1moL苯乙烯(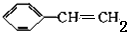 )中含有的碳酸双键数为4NA )中含有的碳酸双键数为4NA | |
| B. | 加热条件下,4.6g金属Na与足量O2反应的产物中阴离子的数目为0.1NA | |
| C. | 室温条件下,pH=9,体积为1L的CH4COONa溶液中,发生电离的水分子数为1.0×10-4NA | |
| D. | 高温条件下,16.6g铁粉与足量水蒸气反应后,转移电子数为0.9NA |
分析 A、苯环中无碳碳双键;
B、4.6g金属钠的物质的量为0.2mol,在加热条件下与氧气反应生成0.1mol过氧化钠;
C、盐的水解促进水的电离;
D、铁与水蒸气反应生成产物为四氧化三铁,根据铁的质量计算出物质的量,再计算出转移的电子数.
解答 解:A、苯环中无碳碳双键,故1mol苯乙烯中含1mol双键,故A错误;
B、4.6g金属钠的物质的量为0.2mol,在加热条件下与氧气反应生成0.1mol过氧化钠,而1mol过氧化钠中含1mol阴离子,故0.1mol过氧化钠中含0.1mol阴离子,故B正确;
C、盐的水解促进水的电离,CH4COONa溶液中,H+和OH-完全来自于水的电离,但由于H+被水解的醋酸根结合掉一部分,故溶液中的OH-的个数才能代表由水电离出的全部,而在室温时,pH=9、体积为1L的CH4COONa溶液中,OH-的物质的量n=CV=10-5mol/L×1L=10-5mol,故电离的水分子的物质的量为10-5mol,故C错误;
D、16.6g Fe的物质的量为$\frac{16.6g}{56g/mol}$≈0.3mol,1molFe参与反应转移$\frac{8}{3}$mol电子,则0.3mol铁与足量水蒸气反应转移0.8mol电子,转移的电子数目为0.8NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.设计实验方案是科学探究的重要环节,以下化学实验设计中,不能达到实验目的是( )
| A. | 用燃着的木条伸入集气瓶中检验二氧化碳 | |
| B. | 用水区分氢氧化钠固体和氯化钠固体 | |
| C. | 用铁粉除去FeSO4溶液中混有的CuSO4 | |
| D. | 用石灰水除去NaOH溶液中混有的Na2CO3 |
12.根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |
9.如图图示与对应的叙述相符的是( )


| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
16.下列各项中表达正确的是( )
| A. | 过氧化钠的分子式:Na2O2 | B. | F-的结构示意图: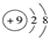 | ||
| C. | NaCl的电子式: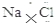 | D. | N2的结构式::N≡N: |
11.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
12.下列鉴别方法不可行的是( )
| A. | 仅用氨水即可鉴别NaCl、AlBr3、FeI2、AgNO3四种溶液 | |
| B. | 用燃烧法鉴别环己醇、苯和四氯化碳 | |
| C. | 用烧碱溶液鉴别地沟油、甘油和石油 | |
| D. | 用新制氯水鉴别碘的淀粉溶液、含石蕊的烧碱溶液、硫酸铜溶液等三种蓝色溶液 |

 +2CH2=C(CH3)2→
+2CH2=C(CH3)2→