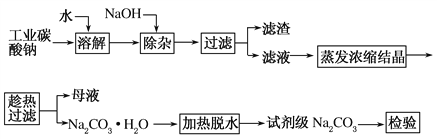
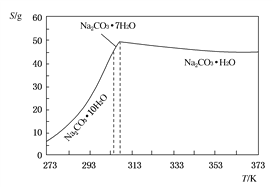
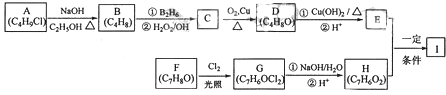
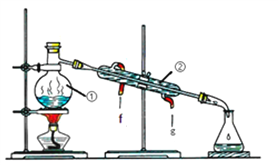
题目内容
【题目】硫在空气中燃烧可以生成SO2 , SO2在催化剂作用下可以被氧化为SO3 , 其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=﹣297kJ/mol,SO2(g)+ ![]() O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
(1)Ⅰ→Ⅱ的反应是(填“吸热”,“放热”)反应.
(2)c为KJ.
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 .
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)图中的d+e﹣b=KJ. 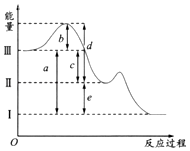
【答案】
(1)吸热
(2)594
(3)D
(4)751.28
【解析】解:(1)由图象可知Ⅰ能量较低,Ⅱ能量较高,则Ⅰ→Ⅱ的反应是吸热反应,所以答案是:吸热;(2)Ⅲ表示64gS(g)与96g O2(g)所具有的能量,可知n(S)=2mol,n(O2)=3mol,Ⅱ为2molSO2(g),1molO2(g)具有的能量,则c为297kJ/mol×2mol=594kJ,所以答案是:594;(3)b为S和氧气的活化能,Ⅲ→Ⅱ反应的△H取决于活化能的差值,与硫和氧气的活化能无关,所以答案是:D;(4)由图象可知d+e﹣b为64gS(g)与96g O2(g)生成0.4mol SO2(g)、1.6mol SO3(g)放出的热量,又热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=﹣297kJ/mol,SO2(g)+ ![]() O2(g)SO3(g),△H=﹣98.3kJ/mol,可知S(g)+
O2(g)SO3(g),△H=﹣98.3kJ/mol,可知S(g)+ ![]() O2(g)═SO3(g)△H=﹣395.3kJ/mol, 则放出的热量为0.4mol×297kJ/mol+1.6mol×395.3kJ/mol=751.28kJ,
O2(g)═SO3(g)△H=﹣395.3kJ/mol, 则放出的热量为0.4mol×297kJ/mol+1.6mol×395.3kJ/mol=751.28kJ,
所以答案是:751.28.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热).