题目内容
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2OHCOO﹣+H3O+
B.CO2+H2OHCO3﹣+H+
C.CO32﹣+H2OHCO3﹣+OH﹣
D.HS﹣+H2OS2﹣+H3O+
【答案】C
【解析】解:A、是甲酸的电离方程式,故A错误;
B、是碳酸的一级电离方程式,故B错误;
C、是碳酸根的水解方程式,故C正确;
D、是硫氢根离子的电离方程式,故D错误.
故选C.
弱离子水解反应的实质是:弱离子和水电离出的氢离子或氢氧根离子结合生成弱电解质的过程,水解方程式用可逆号.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下: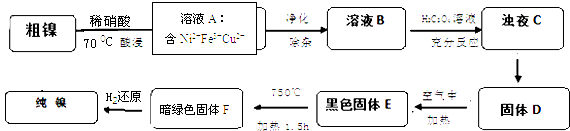
已知:
①2Ni2O3(黑色) ![]() 4NiO(黑色)+O2↑
4NiO(黑色)+O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10﹣38 | 2.2×10﹣20 | 5.48×10﹣18 | 3.2×1018 |
根据信息回答:
(1)28Ni在周期表中的第周期;镍与稀硝酸反应的离子方程式为 . 实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3 . 为了得到纯净的溶液B还需要加入以下物质进行除杂(填正确答案标号).
A.NaOH
B.Na2S
C.H2S
D.NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4H2O>NiC2O42H2O.由浊液C得到固体D的操作包括过滤、、(填操作名称); D生成E的化学方程式为
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32﹣ , C2O42﹣、S2﹣等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为: .