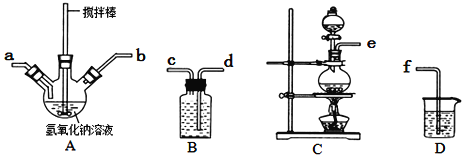
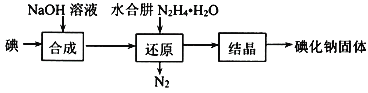
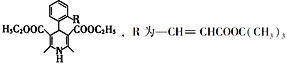题目内容
【题目】求99mL,pH=1的H2SO4与100mLpH=13的NaOH混合后,溶液的pH= ____________
【答案】10.7
【解析】
99mL pH=1的H2SO4溶液n(H+)=0.099L×0.1mol/L=0.0099mol,100mLpH=13的NaOH溶液n(OH-)=0.10L×0.1mol/L=0.01mol,碱过量,反应后溶液呈碱性,依据Kw计算反应后c(H+),可计算pH。
99mL pH=1的H2SO4溶液n(H+)=0.099L×0.1mol/L=0.0099mol,100mLpH=13的NaOH溶液n(OH-)=0.10L×0.1mol/L=0.01mol,碱过量,反应后溶液的体积为99mL+100mL=199mL=0.199L,则反应后c(OH)=![]() ,
, ,pH=lgc(H+)=11lg2=10.7,故答案为:10.7。
,pH=lgc(H+)=11lg2=10.7,故答案为:10.7。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目