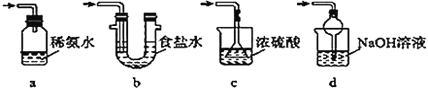
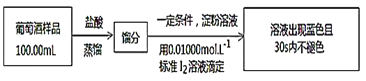
题目内容
【题目】用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是( )
A.![]()
B.![]()
C.![]()
D.c(H+)·c(OH-)
【答案】C
【解析】
用水稀释0.1mol/L氨水时,溶液中随着水量的增加,NH3H2OOH-+NH4+平衡正向移动,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,由于水的离子积不变,则溶液中氢离子浓度最大,据此分析解答。
A.溶液中存在平衡:NH3H2OOH-+NH4+,加水稀释,促进电离平衡正向移动, n(NH3H2O)减小,n(NH4+)增大,则![]() 减小,故A错误;
减小,故A错误;
B.溶液中存在平衡:NH3H2OOH-+NH4+,一水合氨的电离平衡常数为:Kb=![]() ,温度不变,则一水合氨的电离平衡常数不变,故B错误;
,温度不变,则一水合氨的电离平衡常数不变,故B错误;
C.稀释过程中,氢氧根离子浓度减小,而水的离子积不变,则氢离子浓度最大,所以![]() 的比值增大,故C正确;
的比值增大,故C正确;
D.水的离子积为Kw=c(H+)c(OH-),温度不变,则水的离子积不变,故D错误;
故选C。

 作业辅导系列答案
作业辅导系列答案【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。