题目内容
12.某元素原子的N层上只有1或2个电子,则该原子的M层上的电子数可能为( )| A. | 8 | B. | 18 | C. | 8~18 | D. | 18~32 |
分析 根据构造原理知,4s能级大于3p能级而小于3d能级,原子核外电子排列时要遵循能量最低原理,所以排列电子时先排列3p能级再4s能级后排3d能级,且当轨道上电子处于全空、全满或半满时最稳定.
解答 解:根据构造原理知,4s能级大于3p能级而小于3d能级,原子核外电子排列时要遵循能量最低原理,所以排列电子时先排列3p能级再4s能级后排3d能级,且当轨道上电子处于全空、全满或半满时最稳定,某元素原子的N层上只有1或2个电子即4s能级有1个电子或2个电子时,3d能级上可排列电子数是从0到10,所以该原子的第三电子层M电子数可能是8到18,
故选C.
点评 本题考查了基态原子核外电子排布,根据构造原理来分析解答即可,注意Cr和Cu基态原子核外电子排布式的书写特点,为易错点.

练习册系列答案
相关题目
3.下列检验离子的方法及现象描述正确的是( )
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
20.向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色.X和Y可能是( )
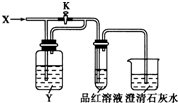
| A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaHCO3 溶液 | 饱和Na2SO3溶液 | 饱和NaCl溶液 | 水 |

| A. | A | B. | B | C. | C | D. | D |
7.某主族元素的电离能(单位:kJ•mol-1)如下表,此元素位于元素周期表的族数是( )
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
4.如图是某有机物的质谱图,其相对分子质量为( )
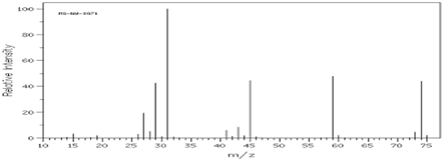

| A. | 74 | B. | 31 | C. | 59 | D. | 45 |
1.以钴酸锂(LiCoO2)为正极材料的锂离子电池已被广泛用作便携式电源,工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②LiCO3在不同温度下的溶解度如下表:回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2;
(2)反应Ⅱ中加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)洗涤所得Li2O3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(2)反应Ⅱ中加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH使Fe3+、Al3+完全沉淀;
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓;
(4)洗涤所得Li2O3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗;
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
2.含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag,下列结论错误的是( )
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属 |
 .
.