题目内容
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)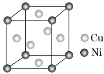 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
【答案】1s22s22p2 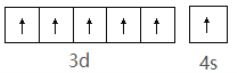 Cl <F > 1:2 > 非极性 sp3 sp2 3:1
Cl <F > 1:2 > 非极性 sp3 sp2 3:1
【解析】
(1)C位于周期表的第二周期ⅣA,属于p区元素,其基态原子电子排布式为1s22s22p2;
(2)基态铬原子的外围电子排布式为3d54s1,相应的电子轨道表示式即电子排布图为![]() ;
;
(3)周期表中同一主族的元素,从上至下,元素的电负性逐渐减小,因此电负性Cl<F;
(4)由于S2-的半径大于O2-,所以Mg2+和S2-的离子键较弱,所以MgS的晶格能较小;
(5)CO分子内C和O原子之间形成的是三键,三键中包含1个σ键和2个π键,因此比例是1:2;
(6)同周期元素,第一电离能从左至右呈现增大趋势;由于Mg的3s轨道处于全充满的状态,能量更低更稳定,因此其第一电离能大于Al的;;
(7)乙炔分子是直线型分子,分子中的正电荷中心和负电荷中心重叠,因此属于非极性分子;
(8)丙烯分子中甲基中的C原子采用sp3的杂化方式,形成碳碳双键的C原子采用sp2的杂化方式;
(9)由晶胞结构可知,Cu原子位于晶胞的面心处,因此一个晶胞中Cu原子的个数为![]() 个;Ni原子位于晶胞的顶点上,因此一个晶胞中Ni原子的个数为
个;Ni原子位于晶胞的顶点上,因此一个晶胞中Ni原子的个数为![]() 个;因此晶胞中Cu原子和Ni原子的个数比为3:1。
个;因此晶胞中Cu原子和Ni原子的个数比为3:1。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案