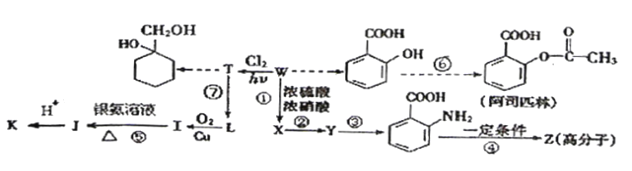
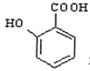
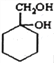
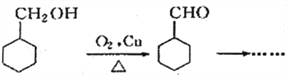
题目内容
【题目】过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1) 根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):_______________。

(2) 装置④的作用:______________________。装置⑤的作用为_________________________________。
(3) 如果实验时,称取wg样品和过量盐酸反应后,设收集到氧气的体积(标准状况)为VmL,则此样品的纯度为______________。(列出计算式,不需化简)
(4) 某次实验,称取1.22g样品进行测定,实验室有50mL,100mL,150mL三种规格的量筒,应选用规格为_______的量筒进行实验。
【答案】(1)aghefdcb(2)检验CO2是否已除净
(3)![]() (4)100mL
(4)100mL
【解析】
试题(1)过碳酸钠和碳酸钠均能与足量的盐酸反应,放出含有CO2和O2的气体,CO2对O2体积测量有干扰,因此利用排水量气法收集O2之前,需要除去CO2并确认CO2已经被完全除尽;图中几个装置的作用分别是制气、量液或O2的体积、排水集O2、确认是否含有CO2、除去CO2,除去并检验CO2时气体应该长进短出,排水集O2时应短进长出,因此这套装置的连接顺序为a→g,h→e,f→d,c→b;
(2)根据以上分析可知装置④的作用是检验CO2是否已除净;
(3)先由n=V/Vm求 n(O2),再由反应式2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O中过碳酸钠与氧气的化学计量数之比等于物质的量之比求 n(Na2CO4),然后再由m=nM求m(Na2CO4),最后由过碳酸钠的质量和样品的质量求纯度,即纯度为![]() 。
。
(4)根据方程式可知0.9g样品最多生成氧气的体积是![]() ,所以需要100mL量筒。
,所以需要100mL量筒。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | |||||||
(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。
试写出:
(1)a粒子的原子结构示意图是________;b粒子的电子排布式为________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,d分子的空间构型为________,键角为________;若d为正四面体形分子,其电子式为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。