题目内容
【题目】我国科研人员在探究如何降低大气中氮氧化物与碳氧化物的含量方面做出了巨大贡献,并取得了显著的成绩。
(1)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H<0,可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。提高尾气净化效率的最佳途径是下列措施中的______(填标号);若要净化汽车尾气的同时提高该反应的速率和NO的平衡转化率,且只改变一个反应条件,则应采取的措施是____(填标号)。
2CO2(g)+N2(g) △H<0,可用于净化汽车尾气,已知570K时该反应的反应速率极慢,平衡常数极大。提高尾气净化效率的最佳途径是下列措施中的______(填标号);若要净化汽车尾气的同时提高该反应的速率和NO的平衡转化率,且只改变一个反应条件,则应采取的措施是____(填标号)。
a.研制、使用高效催化剂 b.升高温度
c.增大压强 d.用碱溶液吸收CO2
(2)已知:△H=产物的总摩尔生成焓-反应物的总摩尔生成焓。25℃,101kPa时,NO、CO、CO2、N2的摩尔生成焓分别为+90.3kJ·mol-1、-110.5kJ·mol-1、-393.5kJ·mol-1、0 kJ·mol-1,则2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的△H=___________________。
2CO2(g)+N2(g)的△H=___________________。
(3)某科研小组根据反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)来探究反应物起始时的碳氮比
2CO2(g)+N2(g)来探究反应物起始时的碳氮比![]() 对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分转化率和氮气的体积分数的变化如图所示。
对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分转化率和氮气的体积分数的变化如图所示。
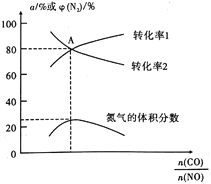
①根据图像推测转化率1曲线表示的是____________(填“CO”或“NO”)。
②A点时,![]() =_______________,氮气的体积分数为____________;T℃时,反应的平衡常数K=________________。
=_______________,氮气的体积分数为____________;T℃时,反应的平衡常数K=________________。
(4)已知:△G=△H-T△S;②△G=-RTlnK,其中K为反应的标准平衡常数,气体常数R=8.314×10-3kJ·mol-1·K-1。298K、101kPa时,2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的△G=-687.6kJ·mol-1,该反应的△G>△H,原因是_________________。298K时,该反应的标准平衡常数K=___________(用含e的指数表示,列出计算式即可)。
2CO2(g)+N2(g)的△G=-687.6kJ·mol-1,该反应的△G>△H,原因是_________________。298K时,该反应的标准平衡常数K=___________(用含e的指数表示,列出计算式即可)。
【答案】 a c -746.6 kJ·mol-1 NO 1 25% 80 L·mol-1 该反应的ΔS<0,所以ΔG=ΔH+∣TΔS∣>ΔH e 687.6/(0.298×8.314)
【解析】分析:本题考查外界条件对化学反应速率和化学平衡的影响、反应热的计算、图像的分析、化学平衡的计算、根据题给公式解题的能力。
(1)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)ΔH
2CO2(g)+N2(g)ΔH![]() 0,该反应的正反应是气体分子数减小的放热反应,根据外界条件对化学反应速率和化学平衡的影响判断。
0,该反应的正反应是气体分子数减小的放热反应,根据外界条件对化学反应速率和化学平衡的影响判断。
(2)根据题给已知:ΔH=产物的总摩尔生成焓-反应物的总摩尔生成焓,代入数据计算反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的ΔH。
2CO2(g)+N2(g)的ΔH。
(3)①增大某一反应物的浓度,平衡向正反应方向移动,提高另一反应物的转化率,自身转化率反而减小,转化率1曲线表示的是NO。
②A点对应的![]() 达到平衡时,转化率1和转化率2相等,氮气的体积分数达最大值,则
达到平衡时,转化率1和转化率2相等,氮气的体积分数达最大值,则![]() 等于化学计量数之比,即为1:1。用三段式和化学平衡常数表达式计算。
等于化学计量数之比,即为1:1。用三段式和化学平衡常数表达式计算。
(4)根据ΔG=ΔH-TΔS分析,将题给数据代入ΔG=-RTlnK计算K。
详解:(1)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)ΔH
2CO2(g)+N2(g)ΔH![]() 0,该反应的正反应是气体分子数减小的放热反应。a项,研制、使用高效催化剂,可极大程度的加快反应速率,化学平衡不移动,NO的平衡转化率不变;b项,升高温度,能加快反应速率,温度每升高10℃,化学反应速率增大到原来的2~4倍,化学平衡向逆反应方向移动,NO的平衡转化率减小;c项,增大压强,能加快反应速率,速率增大不明显,化学平衡向正反应方向移动,NO的平衡转化率增大;d项,用碱液吸收CO2,减小生成物浓度,反应速率减慢,化学平衡向正反应方向移动,NO的平衡转化率增大。在570K时反应速率极慢,平衡常数极大,提高尾气净化效率的最佳途径主要是明显加快反应速率,采取的措施是研制、使用高效催化剂,答案选a。若要净化尾气的同时提高该反应的速率和NO的平衡转化率,应采取的措施是增大压强,答案选c。
0,该反应的正反应是气体分子数减小的放热反应。a项,研制、使用高效催化剂,可极大程度的加快反应速率,化学平衡不移动,NO的平衡转化率不变;b项,升高温度,能加快反应速率,温度每升高10℃,化学反应速率增大到原来的2~4倍,化学平衡向逆反应方向移动,NO的平衡转化率减小;c项,增大压强,能加快反应速率,速率增大不明显,化学平衡向正反应方向移动,NO的平衡转化率增大;d项,用碱液吸收CO2,减小生成物浓度,反应速率减慢,化学平衡向正反应方向移动,NO的平衡转化率增大。在570K时反应速率极慢,平衡常数极大,提高尾气净化效率的最佳途径主要是明显加快反应速率,采取的措施是研制、使用高效催化剂,答案选a。若要净化尾气的同时提高该反应的速率和NO的平衡转化率,应采取的措施是增大压强,答案选c。
(2)反应2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)的ΔH=产物的总摩尔生成焓-反应物的总摩尔生成焓=(-393.5kJ/mol)
2CO2(g)+N2(g)的ΔH=产物的总摩尔生成焓-反应物的总摩尔生成焓=(-393.5kJ/mol)![]() 2+0kJ/mol-[(+90.3kJ/mol)
2+0kJ/mol-[(+90.3kJ/mol)![]() 2+(-110.5kJ/mol)
2+(-110.5kJ/mol)![]() 2]=-746.6kJ/mol。
2]=-746.6kJ/mol。
(3)①根据图像,随着![]() 的增大,转化率1逐渐增大,转化率2逐渐减小;根据“增大某一反应物的浓度,平衡向正反应方向移动,提高另一反应物的转化率,自身转化率反而减小”,转化率1曲线表示的是NO。
的增大,转化率1逐渐增大,转化率2逐渐减小;根据“增大某一反应物的浓度,平衡向正反应方向移动,提高另一反应物的转化率,自身转化率反而减小”,转化率1曲线表示的是NO。
②A点对应的![]() 达到平衡时,转化率1和转化率2相等,氮气的体积分数达最大值,则
达到平衡时,转化率1和转化率2相等,氮气的体积分数达最大值,则![]() 等于化学计量数之比,即为2:2=1:1。起始加入的NO、CO各为2mol,A点NO和CO的转化率都为80%,用三段式
等于化学计量数之比,即为2:2=1:1。起始加入的NO、CO各为2mol,A点NO和CO的转化率都为80%,用三段式
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
c(起始)(mol/L) 2 2 0 0
c(转化)(mol/L)2![]() 0.8 2
0.8 2![]() 0.8 1.6 0.8
0.8 1.6 0.8
c(平衡)(mol/L) 0.4 0.4 1.6 0.8
氮气的体积分数为![]() 100%=25%。反应的平衡常数K=
100%=25%。反应的平衡常数K=![]() =
=![]() =80L/mol。
=80L/mol。
(4)该反应的ΔG![]() ΔH的原因是:该反应的ΔS
ΔH的原因是:该反应的ΔS![]() 0,则ΔG=ΔH-TΔS=ΔH+∣TΔS∣
0,则ΔG=ΔH-TΔS=ΔH+∣TΔS∣![]() ΔH。ΔG=-RTlnK,lnK=-
ΔH。ΔG=-RTlnK,lnK=-![]() =-
=-![]() =
=![]() ,K=
,K=![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | |||||||
(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。
试写出:
(1)a粒子的原子结构示意图是________;b粒子的电子排布式为________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,d分子的空间构型为________,键角为________;若d为正四面体形分子,其电子式为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。