题目内容
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
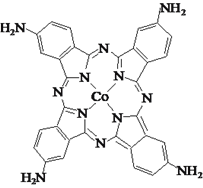
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
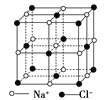
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

【答案】 1s22s22p63s23p63d7或[Ar]3d7 3 钙原子半径较大且价电子数较少,金属键较弱 1.8NA N>O>K sp2、sp3 三角锥 8 CoTiO3
【解析】分析:(1)根据钴的原子序数结合核外电子排布规律解答;
(2)单键都是σ键,双键中含有1个σ键、1个π键;非金属性越强,第一电离能越大;
(3)根据氮原子的成键特点解答;
(4)配体是氨气,据此解答;
(5)根据晶胞结构结合均摊法计算。
详解:(1)钴的原子序数是27,则二价钴离子的核外电子排布式为1s22s22p63s23p63d7或[Ar]3d7。基态Co原子核外电子排布式为1s22s22p63s23p63d74s2,因此3d能级上有3个未成对电子。由于钙原子半径较大且价电子数较少,金属键较弱,因此金属钴的熔沸点都比钙的高。
(2)硝基中含有2个氮氧双键,另外[Co(NO2)6]3-中还含有配位键,一共含有18个σ键,则0.1mol[Co(NO2)6]3-中所含的σ键数目是1.8NA;非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,则K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是N>O>K。
(3)氨基中氮原子全部形成单键,属于sp3杂化;形成双键的氮原子是sp2杂化;
(4)[Co(NH3)6]Cl3中配体分子是氨气,氮原子的价层电子对数是4,其中氮原子含有一对孤对电子,其立体构型是三角锥形。
(5)O2-位于面心处,则晶体中与每个O2-紧邻的O2-有8个,钛原子个数8×1/8=1,氧原子个数是6×1/2=3,钴原子位于晶胞中,个数是1,因此该钴的化合物的化学式是CoTiO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案