题目内容
【题目】工业上测量SO2、N2、O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应(N2、O2不与I2反应)为SO2+I2+2H2O=H2SO4+2HI。
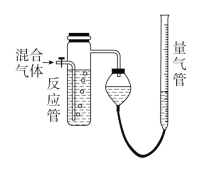
(1)混合气体进入反应管后,量气管内增加的水的体积等于________________(填气体的分子式)的体积。
(2)反应管内的溶液蓝色消失后,没有及时停止通气,则测得的SO2含量________(填“偏高”“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用________(填物质名称)代替。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1。N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量:____________________。
【答案】N2、O2 偏低 酸性高锰酸钾溶液或溴水 ![]() ×100%
×100%
【解析】
(1)剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积;
(2)根据反应SO2+I2+2H2O===H2SO4+2HI可求出吸收的SO2的体积,再求SO2的体积百分含量φ(SO2)=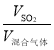 ×100%,再进行判断;
×100%,再进行判断;
(3)反应管内的碘的淀粉溶液可以用能吸收SO2的有色溶液代替;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量,再求SO2的体积百分含量。
(1)混合气体进入反应管中,其中SO2与I2发生反应:SO2+I2+2H2O===H2SO4+2HI,剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积;
(2)根据反应SO2+I2+2H2O===H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)=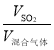 ×100%,式中V(SO2)的量是由n(I2)决定的,而“没有及时停止通气”就会使得V(混合气体)偏大,则φ(SO2)偏低;
×100%,式中V(SO2)的量是由n(I2)决定的,而“没有及时停止通气”就会使得V(混合气体)偏大,则φ(SO2)偏低;
(3)反应管内的碘的淀粉溶液可以用能吸收SO2的有色溶液代替,中学常见且可用的是溴水或酸性高锰酸钾溶液;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量:Va×10-3 L×c mol·L-1=Vac×10-3 mol,
则V(SO2)=Vac×10-3 mol×22400 mL·mol-1=22.4Vac mL,
所以SO2的体积百分含量为![]() ×100%。
×100%。