题目内容
4.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )| A. | 标况下,22.4 L水中氢原子原子数大于1NA | |
| B. | 1LpH=1的醋酸溶液中H+数目为0.1NA | |
| C. | 10g46%的甲酸(HCOOH)水溶液中所含氧原子数为0.5 NA | |
| D. | 1molFe溶于稀硝酸过程中电子转移数为2 NA |
分析 A、标况下水为液体;
B、pH=1的醋酸溶液中,氢离子浓度为0.1mol/L;
C、甲酸水溶液中,除了甲酸中含有氧原子,水中也含氧原子;
D、铁与硝酸反应变为+3价.
解答 解:A、标况下水为液体,故22.4L水的物质的量大于1mol,则含有的氢原子个数大于2NA个,故A正确;
B、pH=1的醋酸溶液中,氢离子浓度为0.1mol/L,故溶液中的氢离子的物质的量n=CV=0.1mol/L×1L=0.1mol,个数为0.1NA个,故B正确;
C、10g46%的甲酸水溶液中,甲酸的质量m=10g×46%=4.6g,物质的量n=$\frac{4.6g}{46g/mol}$=0.1mol,含0.2mol氧原子;水的质量为10g-4.6g=5.4g,物质的量n=$\frac{5.4g}{18g/mol}$=0.3mol,故含0.3mol氧原子,故共含0.5mol氧原子即0.5NA个,故C正确;
D、铁与硝酸反应变为+3价,故1mol铁反应转移2mol电子即2NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
14.金属是热和电的良好导体,因为它( )
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
15.你认为下列数据可信的是( )
| A. | 某溶液中溶质的质量分数超过100% | B. | 某常见气体的密度为1.8g/cm3 | ||
| C. | 用10ml量筒量取5.23ml浓硫酸 | D. | 用托盘天平称得氯化钠 5.0g |
12.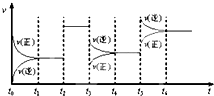 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )| A. | t3 时减小了压强 | |
| B. | t5 时增大了压强 | |
| C. | t6 时刻后反应物的转化率最低 | |
| D. | t1-t2 时该反应的平衡常数大于 t6时反应的平衡常数 |
19.钛(Ti)金属常被称为未来钢铁.钛元素的同位素${\;}_{22}^{46}$Ti、${\;}_{22}^{47}$Ti、${\;}_{22}^{48}$Ti、${\;}_{22}^{49}$Ti、${\;}_{22}^{50}$Ti中,中子数不可能为( )
| A. | 26 | B. | 28 | C. | 22 | D. | 24 |
9.有关比较中,大小顺序排列不正确的是( )
| A. | 物质的熔点:石英>食盐>冰 | |
| B. | 热稳定性:H2O>HI>HBr>HCl | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 微粒的半径:Cl->Na+>Mg2+>Al3+ |
16.下列有关海水综合利用的说法正确的是( )
| A. | 工业上通过氧化法提取海水中的溴 | |
| B. | 工业上电解氯化钠溶液制取单质钠 | |
| C. | 工业利用冷却结晶法提取海水中的食盐 | |
| D. | 利用过滤法除去海水中的杂质生产淡水 |
14.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 氢氧化钠与稀硫酸反应 | B. | 灼热的炭与水蒸气反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧 |