题目内容
【题目】物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2![]() 2(t-BuNO)。在20℃时,向2L正庚烷中加入(t-BuNO)2 1.00 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终保持不变)。下列说法正确的是( )
2(t-BuNO)。在20℃时,向2L正庚烷中加入(t-BuNO)2 1.00 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终保持不变)。下列说法正确的是( )
A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0325 mol·L-1·min-1
B.保持其他条件不变,若此时再向溶液中加入1.0 mol (t-BuNO)2,重新达平衡时(t-BuNO)2
的转化率增大
C.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率小于65%
D.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于65%,则其能量关系可用下图表示:
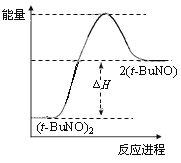
【答案】CD
【解析】
试题分析:A、10 min 内转化的(t-BuNO)2的物质的量为0.65mol,溶液体积为2L,所以ν(t-BuNO)2=0.0325 mol·L-1·min-1,ν(t-BuNO)=0.065 mol·L-1·min-1,错误;B、平衡后再加1.00 mol (t-BuNO)2,反应物浓度增大,根据平衡移动原理,(t-BuNO)2转化率降低,错误;C、原平衡常数约为2.4,若平衡常数为1.9,(t-BuNO)2的平衡转化率小于65%,正确;D、升高温度,(t-BuNO)2的平衡转化率大于65%,说明正反应是吸热反应,正确。

练习册系列答案
相关题目