题目内容
【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂质),制取ZnSO4·7H2O可以采取如下工艺流程:

金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
![]() 回答下列问题:
回答下列问题:
(1)酸溶时常常加入少量的CuSO4,其目的是 。
(2)写出氧化时的离子方程式 。该过程中加入的H2O2量要远多于理论值,原因除了提高另外反应物的转化率外,还可能是 。
(3)调节pH大于8后会造成锌元素转化率降低,其原因是 。
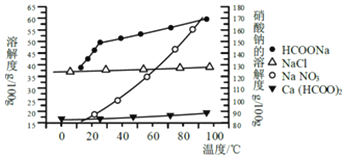
(4)从滤液B获得Na2SO4应该采用的方法是蒸发结晶, ,洗涤干燥。(部分物质的溶解度曲线见下图)

(5)由滤渣B制备ZnSO4·7H2O的实验方案为:_ __ __,干燥得到ZnSO4·7H2O (实验中须使用的试剂有:1mol/LH2SO4,蒸馏水,乙醇;除常用仪器外须使用的仪器有:pH计)。
【答案】
(1)锌置换出铜后形成铜锌原电池加快反应速率(2分)
(2)2Fe2++H2O2+2H+ =2Fe3++ 2H2O(3分)
Fe3+(或Fe2+)催化分解双氧水(2分)
(3)碱性过强氢氧化锌可能溶解(2分)
(4)趁热过滤(2分)
(5)用pH计测定,1mol/LH2SO4加水配制成pH为4(3.7—5.7) 的溶液,加入到滤渣B中充分反应,过滤,将滤液蒸发浓缩,冷却结晶,用乙醇洗涤(4分)
【解析】
试题分析:
(1)在溶液中加入硫酸铜后,锌置换出铜形成铜锌原电池加快反应速率;
(2)酸溶过程中产生Fe2+,双氧水氧化Fe2+为Fe3+,然后调节pH形成氢氧化铁沉淀分离;双氧水易分解,Fe3+(或Fe2+)可为双氧水分解的催化剂,加快双氧水分解,所以应增加双氧水的用量;
(3)pH为8时锌的存在形式为氢氧化锌,碱性增强锌元素转化率降低说明氢氧化锌为两性,溶解于强碱;
(4)滤液B中含有NH4+、Na+、SO42-、Cl-,根据溶解度曲线,硫酸钠溶解度在超过40℃时,随温度升高而降低,氯化铵随温度升高而升高,故采用蒸发浓缩,结晶出硫酸钠晶体,趁热过滤,防止温度降低氯化铵析出;
(5)滤渣B为氢氧化铁和氢氧化锌,根据表中数据得出氢氧化锌在pH小于5.7时溶解,氢氧化铁在pH小于3.7时溶解,所以采用pH为4(3.7—5.7),溶解氢氧化锌,从而分离铁和锌;然后通过浓缩,冷却结晶,用乙醇洗涤、干燥得到产品。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
烯类化合物 | 相对速率 |
(CH3)2C=CHCH3 | 10.4 |
CH3CH=CH2 | 2.03 |
CH2=CH2 | 1.00 |
CH2=CHBr | 0.04 |
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是______(填序号)。
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出 与HBr反应的主要产物的结构简式_____________。
与HBr反应的主要产物的结构简式_____________。
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
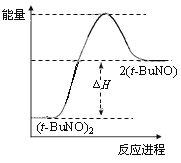
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:

①写出能表示硫的燃烧热的热化学方程式:_________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
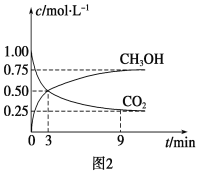
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高