题目内容
【题目】下图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是

A. 五种元素中,只有Z为金属元素
B. W位于ⅥA族,有+6、-2两种常见化合价
C. X和Y的最高价氧化物对应水化物都是强酸
D. X、Y、Z的气态氢化物的稳定性:Y>X>Z
【答案】D
【解析】
R、W、X、Y、Z为元素周期表中前四周期的部分元素,由图可知,R为He,W为O,Y为Cl,X为P,Z为As,则
A.五种元素均为非金属元素,A错误;
B.W为O,位于ⅥA族,有负价,没有最高价,B错误;
C.X的最高价氧化物对应水化物磷酸为中强酸,Y的最高价氧化物对应水化物为高氯酸,高氯酸是强酸,C错误;
D.非金属性Cl>P>As,非金属性越强,氢化物越稳定,则氢化物的稳定性:Y>X>Z,D正确;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
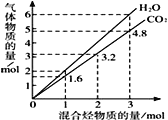
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
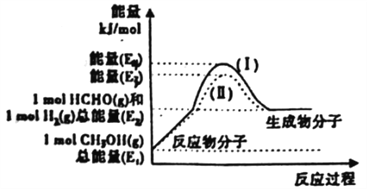
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
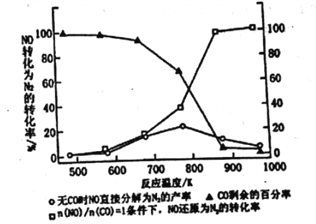
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。
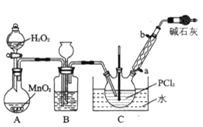
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)