题目内容
【题目】参考如图,按要求回答下列问题: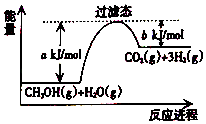
(1)甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O反应生成CO2和H2 . 若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).请写出CH3OH(g)和H2O(g)反应的热化学方程式 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+ ![]() O2(g)CO2(g)+2H2(g)△H=﹣c kJ/mol
O2(g)CO2(g)+2H2(g)△H=﹣c kJ/mol
又知H2O(g)H2O(l)△H=﹣d kJ/mol.
则甲醇燃烧热的热化学方程式为 .
【答案】
(1)减小,不变,CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol
(2)CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol
O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol
【解析】解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a﹣b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;
所以答案是:减小; 不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;
(2)已知:①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
②H2O(g)=H2O(l)△H=d kJ/mol,
③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;
根据盖斯定律①×3﹣2×(③﹣②)可得:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol;
所以答案是:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol.
O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol.
【考点精析】根据题目的已知条件,利用反应热和焓变的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热.

 智慧小复习系列答案
智慧小复习系列答案【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.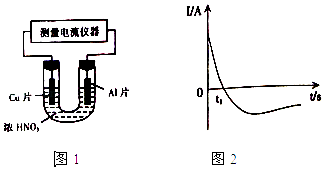
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .