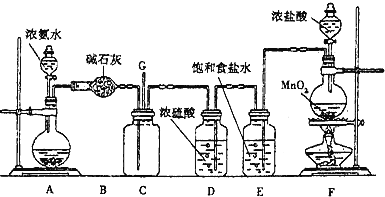
��Ŀ����
����Ŀ��C��N��O��Al��Si��Cu�dz���������Ԫ�أ�
��1��Siλ��Ԫ�����ڱ������ڵ��壮
��2��Nԭ�ӵ�ԭ�ӽṹʾ��ͼΪ��Cu�ĵͼ����������ɫΪ ��
��3���á�����������գ�
ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
AlSi | NO | ���ʯ����� | CH4SiH4 |
��4�������£�����ȥ��������Ĥ��Al��CuƬ����ŨHNO3�����ԭ��أ�ͼ1�������ԭ��صĵ���ǿ�ȣ�I����ʱ�䣨t���ı仯��ͼ2��ʾ����Ӧ�������к���ɫ���������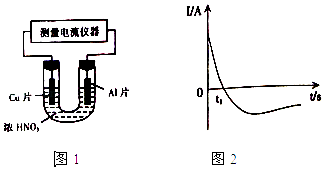
0��t1ʱ��ԭ��صĸ�����AlƬ����ʱ�������ĵ缫��Ӧʽ�� �� ��Һ�е�H+�����ƶ���t1ʱ��ԭ����е��������������ı䣬��ԭ���� ��
���𰸡�
��1����,IVA
��2��![]() ,ש��ɫ
,ש��ɫ
��3����,��,��,��
��4��2H++NO3��+e��=NO2��+H2O,��,����Ũ�����з����ۻ�,����Ĥ��ֹ��Al��һ��������Ӧ,Al������,������Ũ�Ƚ�Ϊһ��Ũ��ʱ��Ϊϡ����,Al��ʼ������,���������������ı�
���������⣺��1��Siԭ�Ӻ�����3�����Ӳ㡢����������Ϊ4������λ�ڵ������ڵ�IVA�壬
�ʴ�Ϊ��������A��
��2��Nԭ�ӽṹʾ��ͼΪ ![]() ��������ͭΪש��ɫ��
��������ͭΪש��ɫ��
�ʴ�Ϊ�� ![]() ��ש��ɫ��
��ש��ɫ��
��3��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С������ԭ�Ӱ뾶Al��Si��
ͬһ����Ԫ�ص縺������ԭ������������������Ե縺��N��O��
ԭ�Ӿ����۷е���ԭ�Ӱ뾶�ɷ��ȣ�ԭ�Ӱ뾶C��Si�������۷е���ʯ������裻
��������ķ��Ӿ����۷е�����Է������������ȣ���Է����������飼���飬�����۷е���飼���飻
ԭ�Ӱ뾶 | �縺�� | �۵� | �е� |
Al��Si | N��O | ���ʯ������� | CH4��SiH4 |
��4����ԭ����У�Al�����ۻ�����Cu��ʧ���Ӷ���������Al��������������ӦʽΪ2H++NO3��+e��=NO2��+H2O����Һ���������������ƶ��������������������ƶ�����Ũ����Ũ�Ƚ��͵�һ���̶��DZ�Ϊϡ���ᣬAl��ʧ���Ӷ������������Ե��������������ı䣬
�ʴ�Ϊ��2H++NO3��+e��=NO2��+H2O����������Ũ�����з����ۻ�������Ĥ��ֹ��Al��һ��������Ӧ��Al��������������Ũ�Ƚ�Ϊһ��Ũ��ʱ��Ϊϡ���ᣬAl��ʼ�����������������������ı䣮
��1�����ݹ�ԭ�ӵĽṹ�����ж���Ԫ�����ڱ��е�λ�ã�
��2����ԭ�����������Ӳ㣬�������5�����ӣ�
��3������ͬ����Ԫ��ԭ�ӵİ뾶���縺���Լ�ͬ���嵥�ʵ��۷е㡢��̦�⻯��ķе�仯���ɽ����жϣ�
��4����������Ũ�����ڳ����·����ۻ�����ͭ��Ũ���ᷴӦ���ݴ��ж�ԭ��صĵ缫��Ȼ����з�������.

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�