题目内容
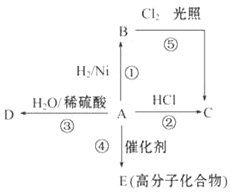
【题目】有短周期主族元素A、B、C、D、E,其中A为地壳中含量最高的金属元素,B元素原子的M层电子数为最内层电子数的2倍,C的气态氢化物的水溶液呈碱性,D元素的最外层电子数是电子层数的3倍,E的单质为黄绿色气体,是制备漂白粉的原料。
请回答下列问题:
(1)D元素在周期表中的位置:______.
(2)A、D、E元素简单离子半径由大到小的顺序为________________(用微粒符号填).
(3)F与D同主族且相邻,其气态氢化物稳定性由大到小为___________(填化学式).
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式______,该阳离子中存在的化学键有______.
(5)C元素的简单气态氢化物与E元素的单质反应有白烟生成,化学方程式为______.
(6)B的单质与强碱反应的离子方程式为______.
【答案】 第二周期第ⅥA族 Cl->O2->Al3+ H2O>H2S ![]() 极性共价键 8NH3 +3Cl2 = 6NH4Cl+N2 Si+2OH—+H2O=SiO32—+2H2↑
极性共价键 8NH3 +3Cl2 = 6NH4Cl+N2 Si+2OH—+H2O=SiO32—+2H2↑
【解析】短周期主族元素A、B、C、D、E,其中A为地壳中含量最高的金属元素,A为Al元素;B元素原子的M层电子数为最内层电子数的2倍,B为Si元素;C的气态氢化物的水溶液呈碱性,C为N元素;D元素的最外层电子数是电子层数的3倍,D为O元素;E的单质为黄绿色气体,是制备漂白粉的原料,E为Cl元素。
(1)D为O元素,在周期表中位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)一般而言,离子的电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,A、D、E元素简单离子半径由大到小的顺序为Cl->O2->Al3+,故答案为:Cl->O2->Al3+;
(3)F与D同主族且相邻,F为S元素,元素的非金属性越强,气态氢化物越稳定,气态氢化物稳定性由大到小为H2O>H2S,故答案为:H2O>H2S;
(4)用高能射线照射含有10电子的O元素氢化物分子时,一个水分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,该阳离子为H2O+,电子式为![]() ,该阳离子中存在的化学键有极性共价键,故答案为:
,该阳离子中存在的化学键有极性共价键,故答案为: ![]() ;极性共价键;
;极性共价键;
(5)C为N元素,E为Cl元素,氨气遇氯化氢气体能够反应生成氯化铵白烟,反应化学方程式为8NH3 +3Cl2 = 6NH4Cl+N2,故答案为:8NH3 +3Cl2 = 6NH4Cl+N2;
(6)B为Si元素;硅与强碱反应的离子方程式为Si+2OH—+H2O=SiO32—+2H2↑,故答案为:Si+2OH—+H2O=SiO32—+2H2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
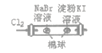
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D