题目内容
钢铁腐蚀在生活和生产中相当普遍。下列措施能防止钢铁腐蚀的是
| A.把钢铁雕塑焊接在铜质基座上 | B.将输送自来水的铁管表面镀锌 |
| C.经常用自来水冲洗钢铁制品 | D.将输油铸铁管道埋在潮湿、疏松的土壤中 |
B
正确答案:B
A、不正确,一定条件下形成原电池时,铁作负极,腐蚀更快;B、正确,一定条件下形成原电池时,铁作正极,活泼的锌作负极;C、不正确,自来水中有漂白粉,有强氧化性,将铁氧化;D、不正确,将输油铸铁管道埋在潮湿、疏松的土壤中,更容易形成原电池,加速腐蚀。

练习册系列答案
相关题目
 2PbSO4+2H2O
2PbSO4+2H2O 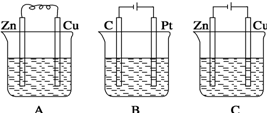
 nLiF+nC。则下列说法不正确的是
nLiF+nC。则下列说法不正确的是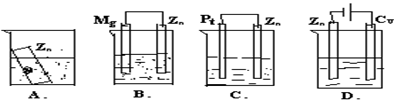
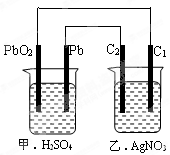 ⑵乙装置中C1电极为
⑵乙装置中C1电极为