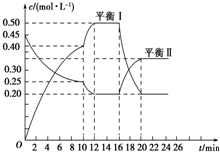
题目内容
12.48g RO${\;}_{4}^{2-}$中,核外电子总数比质子总数多6.02×1023个,则R的摩尔质量为32g/mol.分析 6.02×1023个粒子的物质的量为1mol,说明RO42-所带电荷的物质的量为1mol,则其物质的量为0.5mol,据此可计算出RO42-的摩尔质量,再结合氧元素的摩尔质量计算出R的摩尔质量.
解答 解:48g RO42-中,核外电子总数比质子总数多6.02×1023个,说明说明RO42-所带电荷的物质的量为1mol,则其物质的量为:$\frac{1mol}{2}$=0.5mol,RO42-的摩尔质量为:$\frac{48g}{0.5mol}$=96g/mol,则R的摩尔质量为:96g/mol-16g/mol×4=32g/mol,
故答案为:32g/mol.
点评 本题考查了物质的量的有关计算知识,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系为解答关键,试题充分考查学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.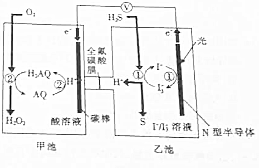 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
已知甲池中发生的反应为: 下列说法正确的是( )
下列说法正确的是( )
 我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2─H2O2+S↓.已知甲池中发生的反应为:
 下列说法正确的是( )
下列说法正确的是( )| A. | 该装置将电能转化为光能 | |
| B. | H+从甲池移向乙池 | |
| C. | 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ | |
| D. | 乙池溶液中发生的反应为H2S+I3-═3I-+S↓+2H+ |
3.下列说法正确的是( )
| A. | 1 L水溶解了0.5 molNaCl,则该溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 把100g 18.4 mol•L-1的硫酸与等质量的水混合,所得溶液的浓度小于9.2 mol•L-1 | |
| C. | 将 100g10%的盐酸加热蒸发,得到 50 g溶液,其质量分数为20% | |
| D. | 把200mL3 mol•L-1的BaCl2溶液跟100mL3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 |
7.能正确表示下列化学反应的离子方程式是( )
| A. | 金属铁溶于盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸镁溶于硝酸中:2H++CO32-═CO2↑+H2O | |
| C. | 石灰乳与碳酸钠溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
4.只用一种试剂,区别甲苯、己烯、四氯化碳、碘化钾溶液、乙醇五种无色液体,可以选用的试剂是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 碘水 | D. | 硝酸银溶液 |