题目内容
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
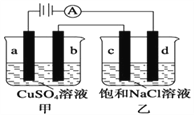
A. 乙烧杯中d的电极反应为 2Cl––2e– =Cl2↑
B. a、c两极产生气体的物质的量相等
C. 乙烧杯中发生的反应为2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D. 甲、乙两烧杯中溶液的pH均保持不变
【答案】C
【解析】该装置是电解池,a、c是阳极,b、d是阴极,a电极上氢氧根离子放电、c电极上氯离子放电,b电极上铜离子放电、d电极上氢离子放电,甲中发生2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O
2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。A.乙烧杯中d的电极反应为2H++2e-=H2↑,故A错误;B.a电极反应式为4OH--4e-=2H2O+O2↑,c电极反应式为2Cl--2e-=Cl2↑,a,c两极产生气体的物质的量为1:2,不相等,故B错误;C.乙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑。A.乙烧杯中d的电极反应为2H++2e-=H2↑,故A错误;B.a电极反应式为4OH--4e-=2H2O+O2↑,c电极反应式为2Cl--2e-=Cl2↑,a,c两极产生气体的物质的量为1:2,不相等,故B错误;C.乙中发生2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故C正确;D.甲中发生2CuSO4+2H2O
2NaOH+H2↑+Cl2↑,故C正确;D.甲中发生2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O
2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,所以甲中溶液变为酸、乙中溶液变为碱,所以二者的pH都改变,故D错误;故选C。
2NaOH+H2↑+Cl2↑,所以甲中溶液变为酸、乙中溶液变为碱,所以二者的pH都改变,故D错误;故选C。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
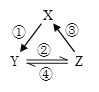
全程金卷系列答案【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
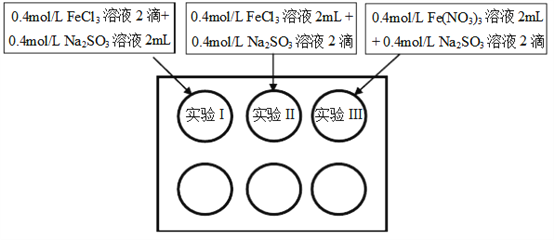
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-