题目内容
【题目】利用相关知识填空.
(1)标准状况下11.2L![]() 中含______个电子.
中含______个电子.
(2)4.8gCH4中所含氢原子数与______g水所含氢原子数相等.
(3)12.4gNa2R含Na+0.4mol,则Na2R中R原子的摩尔质量为______。
(4)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______g.
【答案】5NA或者3.01×1024 10.8 16g/mol 28
【解析】
利用求物质的量的几个公式进行计算。
(1)标准状况下,n(NH3)=11.2L/22.4L·mol-1=0.5mol。又![]() ~10e-,则n(e-)=n(NH3)×10=5mol,电子数为3.01×1024 。
~10e-,则n(e-)=n(NH3)×10=5mol,电子数为3.01×1024 。
(2)设4.8gCH4中所含氢原子数与mg水所含氢原子数相等。则![]() =
=![]() ,解得m=10.8。
,解得m=10.8。
(3)有0.4molNa+,则有0.2molNa2R。Na2R的物质的量为12.4g/0.2mol=62g/mol,Na2R中R原子的摩尔质量为(62-23×2)g/mol=16g/mol。
(4)设N2的质量是x g。据题意得![]() ,x=28 。
,x=28 。

【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
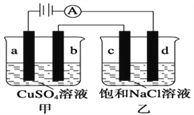
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。