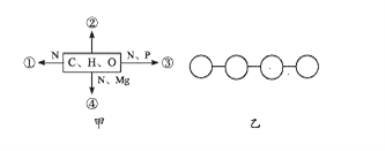
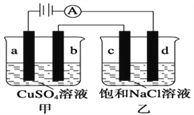
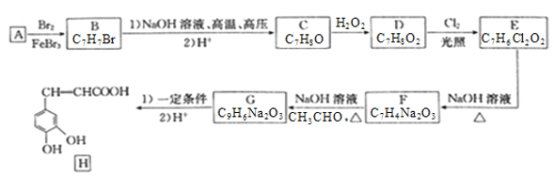
题目内容
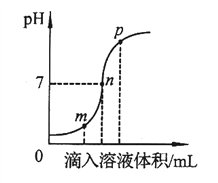
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,PbI的Ksp为2×10-6
B. 温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
【答案】D
【解析】分析:溶液中存在碘化铅的溶解平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),根据外界条件(例如温度、浓度等)对溶解平衡、溶度积常数的影响,结合图像中离子浓度的变化趋势分析解答。
Pb2+(aq)+2I-(aq),根据外界条件(例如温度、浓度等)对溶解平衡、溶度积常数的影响,结合图像中离子浓度的变化趋势分析解答。
详解:A、根据图像知常温下平衡时溶液中c(Pb2+)、c(I-)分别是10-3mol/L、2×10-3mol/L,因此PbI2的Ksp=c(Pb2+)·c2(I-)=4×10-9,A错误;
B、PbI2饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,平衡逆向移动,最终平衡时Pb2+浓度仍然比原平衡时大,B错误;
Pb2+(aq)+2I-(aq),温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,平衡逆向移动,最终平衡时Pb2+浓度仍然比原平衡时大,B错误;
C、根据图像知T时刻改变的条件是增大碘离子浓度,温度不变,PbI2的Ksp不变,C错误;D、反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数K=c2(I-)/c(S2-)=Ksp(PbI2)/Ksp(PbS)=5×1018,D正确。答案选D。
PbS(s)+2I-(aq)的化学平衡常数K=c2(I-)/c(S2-)=Ksp(PbI2)/Ksp(PbS)=5×1018,D正确。答案选D。

【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
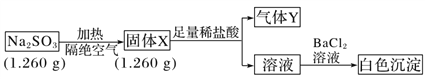
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。