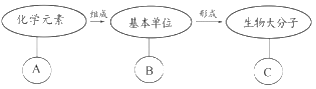
��Ŀ����
����Ŀ���밴Ҫ�ش��������⣺
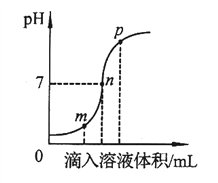
��1����ͬ���ʵ�����SO2��SO3������O������֮��Ϊ________��
��2����״���£�4.48 L ��NH3�У�����H����ĿԼΪ________��
��3����״���£�1 mol H2O��11.2 L CH 4��8 g O2�У������С����________��
��4��ij���������Ϊ3.4 g������6.02��1022�����ӣ���������Ħ������Ϊ________��
��5��10 mL 0.5 mol��L-1 Al (NO3)3 ��Һ��NO3�������ʵ���Ũ��Ϊ________��
��6����״���£�89.6 L HCl ��������1 Lˮ���� = 1 g��mL-1���У�����������ܶ�Ϊ1.146 g��mL-1�������������ʵ���Ũ��Ϊ________��
���𰸡�2��3 3.612��1023 1 mol H2O 34 g��mol-1 1.5 mol��L-1 4 mol��L-1
��������
��1�����ʵ���֮�ȵ��ڷ�����Ŀ֮�ȣ������÷��ӵĹ�������������O�����ʵ���֮�ȣ������õ�������֮�ȣ�
��2������ n = ![]() =
= ![]() ��������ʵĹ��ɼ�����
��������ʵĹ��ɼ�����
��3����״���£�ˮΪҺ�壬CH4��O2Ϊ���壬��������״̬���������
��4������n = ![]() �����������ʵ������ٸ���M =
�����������ʵ������ٸ���M = ![]() ���������Ħ��������
���������Ħ��������
��5��ͬһ��Һ�У�����Al (NO3)3��ȫ��������Ӹ���֮�ȵ�����Ӧ�����ʵ���Ũ��֮�ȣ�
��6������n= ![]() ����HCl�����ʵ���������m = nM����HCl�����������mˮ =��Vˮ����ˮ��������������ͨ��V =
����HCl�����ʵ���������m = nM����HCl�����������mˮ =��Vˮ����ˮ��������������ͨ��V = ![]() �����Һ�������������c =
�����Һ�������������c = ![]() �����������ʵ���Ũ�ȣ��ó����ۣ�
�����������ʵ���Ũ�ȣ��ó����ۣ�
��1����SO2��SO3�����ʵ�����ͬ�����Ϊ1 mol�����������������ԭ�ӵ����ʵ���֮��Ϊ2:3����ԭ��Ħ������Ϊ16 g/mol��������O������֮��Ϊ2��3��
�ʴ�Ϊ��2:3��
��2��n(NH3)=![]() = 0.2 mol����N(H)= 3 N(NH3) = 3��0.2mol��NA/mol = 0.6 NA = 3.612��1023��
= 0.2 mol����N(H)= 3 N(NH3) = 3��0.2mol��NA/mol = 0.6 NA = 3.612��1023��
�ʴ�Ϊ��3.612��1023��
��3�����������Ϊ���壬ˮΪҺ�壬1molˮ������Ϊ18g��ˮ���ܶ�ԼΪ1 g/cm3�������Ϊ18 mL��8 g O2��ռ���ΪV(O2) = ![]() = 5.6 L���Ա��������ʣ�ˮ��ռ�����С��
= 5.6 L���Ա��������ʣ�ˮ��ռ�����С��
�ʴ�Ϊ��1 mol H2O��
��4���������ʵ���Ϊn = ![]() =
= ![]() = 0.1mol��������Ħ������ΪM =
= 0.1mol��������Ħ������ΪM = ![]() =
= ![]() = 34 g/mol��
= 34 g/mol��
�ʴ�Ϊ��34 g/mol��
��5������Һ������ΪAl (NO3)3 ��Һ�������ʵ���Ũ��Ϊ0.5 mol��L-1����Al(NO3)3��ȫ���룬���뷽��ʽΪ��Al(NO3)3 = Al3++ 3NO3-�����������ͬ����c(NO3-) = 3![]() 0.5 mol��L-1 = 1.5 mol��L-1
0.5 mol��L-1 = 1.5 mol��L-1
��6�������89.6 L HCl�����ʵ���Ϊ��n(HCl) = ![]() = 4 mol��m(HCl) = 4mol��36.5g/mol=146 g��
= 4 mol��m(HCl) = 4mol��36.5g/mol=146 g��
��Һ����Ϊ��146g+1000mL��1g/mL=1146g��
����Һ�����Ϊ�� ![]() = 1000 mL= 1L��
= 1000 mL= 1L��
���Ը���������ʵ���Ũ��Ϊ��c(HCl) = ![]() = 4 mol/L��
= 4 mol/L��
�ʴ�Ϊ��4mol/L��

����Ŀ��I. �����ȷ�Ӧ���Ļ�ѧ����ʽΪ2Al��Fe2O3![]() Al2O3��2Fe��ijͬѧ�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ������
Al2O3��2Fe��ijͬѧ�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ������
���ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | ���� |
��1����ͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������Ʋ���һ���ĵ�����������____________________________________________________________��
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________�����۲쵽________ʱ��˵���������к��н�������
��3��ʵ�����ܽ����������ѡ�������Լ��е�____������ĸ����
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
II. ��֪����Na2SO3�����ֽ⡣ʵ�����̺ͽ�����£�
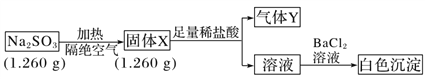
����Y��һ�ִ�����ڱ�״���µ��ܶ�Ϊ1.518 g��L��1����ش�
��4������Y���ӵĵ���ʽ______________����ɫ�����Ļ�ѧʽ______________��
��5����������Na2SO3���ȷֽ�Ļ�ѧ����ʽ____________________________________��
��6����ȡ����X������Na2SO3��ϣ���ˮ�ܽ����ϡ���ᷴӦ���е���ɫ����������д����������ɫ���������ӷ���ʽ__________________________ (�����ǿ�����Ӱ��)��
����Ŀ������ͬ���ܱ������У��øߴ�������Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2 H2O(g)![]() 2 H2(g) + O2(g) H>0��ʵ���÷�Ӧ��ϵ��ˮ����Ũ�ȣ�mol/L���ı仯������£�
2 H2(g) + O2(g) H>0��ʵ���÷�Ӧ��ϵ��ˮ����Ũ�ȣ�mol/L���ı仯������£�
��� | ʱ��/min | 0 | 10 | 20 | 30 | 40 | 60 |
�� | �¶�T1 / 1��Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
�� | �¶�T1 / 2��Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
�� | �¶�T2 / 2��Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
����˵������ȷ����
A. ʵ���ǰ20 min��ƽ����Ӧ����v(O2) = 7��10��5 mol/( L��min)
B. ʵ������������µ�ƽ�ⳣ����ȣ���С��ʵ��������µ�ƽ�ⳣ��
C. 2��Cu2O�Ĵ�Ч�ʱ�1��Cu2O�Ĵ�Ч�ʸ�
D. ʵ��ʱ���¶�T2����T1