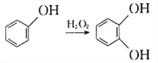
题目内容
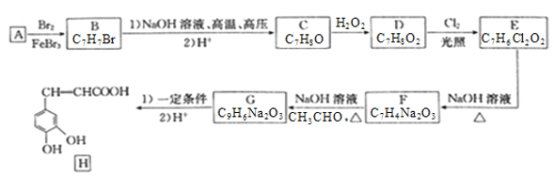
【题目】已知苯可以进行如下转化:
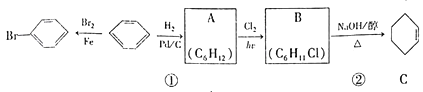
(1)反应①的反应类型为_________,化合物C的化学名称为_________。
(2)B转化为C的方程式为_________________________________________。
(3)如何仅用水鉴别苯和溴苯__________________________________________。
(4)写出苯的同分异构体结构简式(至少写两种)____________________________________________。
【答案】 加成(还原)反应 环己烯 ![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O 在试管中加入少量水,向其中加入几滴苯或溴苯未知液体,若沉入水底,则该液体为溴苯;若浮于水面,则该液体为苯(或其他合理答案)
+NaCl+H2O 在试管中加入少量水,向其中加入几滴苯或溴苯未知液体,若沉入水底,则该液体为溴苯;若浮于水面,则该液体为苯(或其他合理答案) ![]() 、
、![]() 、CH≡C-C≡C-CH2CH3等合理答案
、CH≡C-C≡C-CH2CH3等合理答案
【解析】试题分析:本题主要考查苯的性质、卤代烃的性质、有机反应类型的判断、有机方程式的书写、苯的同分异构体的书写。![]() 与H2发生加成反应生成的A的结构简式为
与H2发生加成反应生成的A的结构简式为![]() ;
;![]() 与Cl2光照下发生取代反应生成B,根据B的分子式可推知B的结构简式为
与Cl2光照下发生取代反应生成B,根据B的分子式可推知B的结构简式为![]() ;B在NaOH/醇、加热时发生消去反应生成C。
;B在NaOH/醇、加热时发生消去反应生成C。
(1)反应①为苯与H2反应生成![]() ,反应①为加成反应或还原反应。化合物C的结构简式为
,反应①为加成反应或还原反应。化合物C的结构简式为![]() ,C属于环烯烃,C的名称为环己烯。
,C属于环烯烃,C的名称为环己烯。
(2)B发生消去反应生成C,反应的方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O。
+NaCl+H2O。
(3)苯和溴苯都为难溶于水的液体,苯的密度比水小,溴苯的密度比水大。用水鉴别苯和溴苯的方法:在试管中加入少量水,向其中加入几滴苯或溴苯未知液体,若未知液体沉入水底,则该液体为溴苯;若浮于水面,则该液体为苯。
(4)苯的分子式为C6H6,不饱和度为4,苯的同分异构体的结构简式有:![]() 、CH
、CH![]() C—C
C—C![]() C—CH2CH3、CH
C—CH2CH3、CH![]() C—CH=CH—CH=CH2、CH2=CH—C
C—CH=CH—CH=CH2、CH2=CH—C![]() C—CH=CH2等。
C—CH=CH2等。

【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
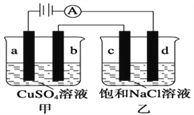
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。