题目内容
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和___探究温度对该反应速率的影响; (Ⅲ)实验①和___探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=___(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为___,可能原因是___。
③反应速率最小的时间段为___,可能原因是___。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是___(填相应字母);
A.蒸馏水 B.NaNO3溶液 C.NaCl溶液 D.CuSO4溶液 E.Na2CO3
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
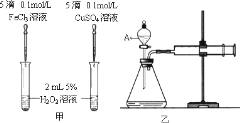
①定性如图甲可通过观察___,定性比较得出结论。甲同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___;
②定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是___。
【答案】③ ④ 0.056 mol·L-1·s-1 40s~50s 从反应放热角度回答皆可 90s~100s 从盐酸浓度降低角度回答皆可 C 反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 控制阴离子相同,排除阴离子不同造成的干扰 通过活塞的移动观察,相同时间内产生气体量的多少 收集40mL气体所需要的时间
【解析】
(1)探究温度对该反应速率的影响,则固体的表面积以及盐酸的浓度应该是一样的,所以实验①和③作为对照;探究锌规格(粗、细)对该反应速率的影响,要求实验温度以及盐酸的浓度是相等的,所以实验①和④作为对照;
(2)①在30-40s范围内生成氢气的物质的量为![]() ==0.007mol,则消耗盐酸的物质的量是0.014mol,其浓度是0.014mol÷0.025L=0.56mol/L,所以在30-40s范围内盐酸的平均反应速率v(HCl)=0.56mol/L÷10s=0.056mol/(L·s);
==0.007mol,则消耗盐酸的物质的量是0.014mol,其浓度是0.014mol÷0.025L=0.56mol/L,所以在30-40s范围内盐酸的平均反应速率v(HCl)=0.56mol/L÷10s=0.056mol/(L·s);
②根据相同时间段内,产生的氢气的体积越大,可以确定反应速率越快,所以反应速率最大的时间段是40~50s,可能原因是反应放热,温度高,反应速率快;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,所以反应速率最大的时间段是90~100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率慢;
(3)在盐酸中加入蒸馏水,氢离子浓度降低,反应速率减小,但产生的氢气量不变,A错误;在盐酸中加入加入NaNO3溶液相当于是硝酸,不能产生氢气,B错误;NaCl溶液相当于将盐酸稀释,盐酸中氢离子浓度减小,所以速率减慢,C正确;在反应中加入硫酸铜,则金属锌会置换出金属铜,形成Cu、Zn、盐酸原电池,会加快反应速率,D错误;在盐酸中加入碳酸钠与盐酸发生反应,氢离子浓度降低,反应速率减小,但产生的氢气体积也减小,E错误,故答案为C;
(4)①定性该反应中产生气体,所以可根据生成气泡的快慢判断。由于阴离子也可能会对反应速率产生影响,所以将FeCl3改为Fe2(SO4)3可以控制阴离子相同,排除阴离子不同造成的干扰;同时,如利用乙图装置,通过测量相同时间内产生气体的量也可达到判断催化效果;
②定量该反应是通过生成气体的反应速率分析判断的,所以根据化学反应速率的计算公式可知,需要测量的数据是产生40ml气体所需要的时间。