题目内容
18.在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42-的浓度为4mol/L,当加入等体积4mol/L KOH溶液时,生成的沉淀恰好完全溶解,则反应后溶液中K+的浓度约为( )| A. | 9 mol/L | B. | 4.5 mol/L | C. | 2.5 mol/L | D. | 2.25 mol/L |
分析 根据当加入等体积4mol/L KOH溶液时,生成的沉淀恰好完全溶解,根据反应方程式求出原溶液中铝离子的浓度,根据电荷守恒计算原溶液中钾离子的浓度,再加上所加KOH的中钾离子的物质的量,可计算反应后钾离子的总浓度.
解答 解:设体积均为1L,由于生成沉淀完全溶解,所以反应为
Al3++4OH-=AlO2-+2H2O
1 4
x 4mol
则:x=1mol,即溶液中含有1molAl3+,
原溶液中只含有K+,Al3+和SO42-,根据电荷守恒可得:n(K+)+3n(Al3+)=2n(SO42-),带人n(Al3+)=1mol、n(SO42-)=4mol解得:n(K+)+3×1mol=2×4mol,
解得:n(K+)=5mol,
而反应时又KOH引入了4molK+,所以K+总量为9mol,
反应后溶液体积变为2L,
所以反应后溶液中钾离子浓度为:c(K+)=9mol2L=4.5mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确质量守恒和电荷守恒在化学计算中的应用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | |
| B. | 乙醇的分子式C2H5OH | |
| C. | 乙酸乙酯的结构简式 CH3CH2OOCCH3 | |
| D. | 羟基 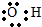 |
6.如图所示验装置是探究铜丝与过量浓硫酸的反应,下列叙述不正确的是( )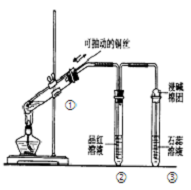

| A. | 装置①能控制反应的发生和结束 | |
| B. | 若将反应后②的试管取下,在通风橱中加热,会产 生刺激性气味的气体,溶液呈红色 | |
| C. | ③中石蕊溶液变红色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
18.下列有关实验操作中合理的是( )
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |

