题目内容
6.如图所示验装置是探究铜丝与过量浓硫酸的反应,下列叙述不正确的是( )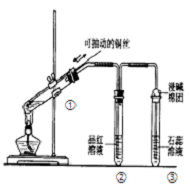
| A. | 装置①能控制反应的发生和结束 | |
| B. | 若将反应后②的试管取下,在通风橱中加热,会产 生刺激性气味的气体,溶液呈红色 | |
| C. | ③中石蕊溶液变红色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
分析 A.通过移动铜丝,可以控制反应的开始与结束;
B.二氧化硫的漂白是暂时的,不稳定的,加热后能够恢复;
C.二氧化硫为酸性氧化物,其水溶液呈酸性,能够使石蕊试液变红;
D.根据溶液颜色的变化判断是否有CuSO4生成.
解答 解:A.通过移动铜丝,可以控制该反应的开始与结束,从而能够节约能源、保护环境,故A正确;
B.二氧化硫的漂白性不稳定的,加热后能够恢复,所以若将反应后②的试管取下,在通风橱中加热,会产生刺激性气味的气体-二氧化硫,溶液又恢复红色,故B正确;
C.二氧化硫为酸性氧化物,二氧化硫溶于水生成亚硫酸,故其水溶液呈酸性,能够使石蕊试液变红,故C正确;
D.反应后的溶液中含有浓硫酸,不能向①中加水,能够将①的溶液慢慢加入水中,然后观察溶液颜色,故D错误;
故选D.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度不大,注意掌握浓硫酸的性质,明确二氧化硫的性质及检验方法为解答关键.

练习册系列答案
相关题目
17.反应A+3B2?2C+2D在四种不同情况下的反应速率分别为( )
①v(A)=0.15mol•L-1•s-1②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1 ④v(D)=0.45mol•L-1•s-1
该反应进行的快慢顺序为:
①v(A)=0.15mol•L-1•s-1②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1 ④v(D)=0.45mol•L-1•s-1
该反应进行的快慢顺序为:
| A. | ②>④>③>① | B. | ④>③>②>① | C. | ④>③=②>① | D. | ②>③=④>① |
14.某HCl溶液的pH=1.0,则该盐酸溶液中c(H+)为( )mol/L.
| A. | 0.1 | B. | 1×10-3 | C. | 1×10-7 | D. | 1×10-13 |
1.下列说法正确的是( )
| A. | 蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物 | |
| B. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
11.若1mol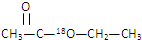 与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )
与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )
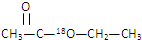 与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )
与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )| A. | 8mol | B. | 小于8mol | C. | 等于10mol | D. | 小于10mol |
18.在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42-的浓度为4mol/L,当加入等体积4mol/L KOH溶液时,生成的沉淀恰好完全溶解,则反应后溶液中K+的浓度约为( )
| A. | 9 mol/L | B. | 4.5 mol/L | C. | 2.5 mol/L | D. | 2.25 mol/L |

 (2)D和B互为同分异构体,且其苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗的Na,NaOH的物质的量之比为2:3,请写出两种D的结构简式为
(2)D和B互为同分异构体,且其苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na和NaOH反应,等质量的D消耗的Na,NaOH的物质的量之比为2:3,请写出两种D的结构简式为 或
或
 .
.