题目内容
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |
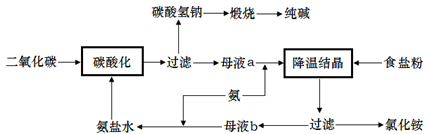
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
(15分)(1)BC(2分)(2)①HCO3-+OH-=CO32-+H2O, Mg2+ +2OH-=Mg(OH)2↓
Ca2+ + HCO3-+OH-=CaCO3↓+H2O (任选其二,其他合理写法也对,每空2分)
②胶状Fe(OH)3 (2分); 除去Ca2+ ; 调节pH (每空2分)
③杀菌消毒 (1分) ; a c e (2分)
解析试题分析:(1)A、因为氨气溶解度非常大,先通氨气后通二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故A步正确;
B、化学反应产物的循环利用可以提高原料利用率,故B正确;
C、电解饱和食盐水时,在阴极上产生的是氢气和氢氧化钠,在阳极上产生的是氯气,采用离子交换膜法,可防止阳极室产生的C12进入阴极室,所以选项C正确;
D、氯化铝是共价化合物,熔融时不能导电,所以工业上采用电解熔融氧化铝的方法制取金属铝,D不正确;
E、石油裂化属于化学变化,主要目的是为了提高汽油的产量和质量,E不正确,答案选BC。
(2)①氢氧化钙是强碱,能和氯化镁反应生成氯化钙和氢氧化镁沉淀,化学反应的离子方程式是Mg2+ +2OH-=Mg(OH)2↓;氢氧化钙也能和HCO3-反应生成CO32-,进而生成碳酸钙沉淀,反应的离子方程式是HCO3-+OH-=CO32-+H2O和Ca2+ + HCO3-+OH-=CaCO3↓+H2O。
②亚铁离子具有还原性,易被氧化生成铁离子,铁离子水解生成氢氧化铁胶体,所以FeSO4·7H2O在水中最终生成胶状Fe(OH)3沉淀。CO2是酸性氧化物,反应中氢氧化钙过量,所以通入CO2的目的是除去过量的Ca2+和调节溶液的pH。
③气体A的作用是杀菌消毒,其中具有强氧化性的物质是ClO2 、K2FeO4、漂白粉,所以可以代替A的消毒剂是选项ace。
考点:考查化工生产的有关判断;水的净化与处理等

【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: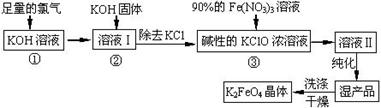
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(7)如何判断K2FeO4晶体已经洗涤干净 。
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。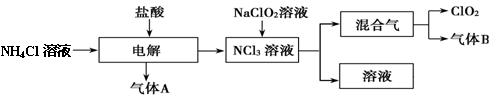
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和监测及警报装置 |
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
下列说法不正确的是
| A.乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 |
| B.乙酸乙醋在碱性条件下水解,属于皂化反应 |
| C.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| D.道尔顿首次提出原子学说、汤姆生发现电子、卢瑟福确定原子核的存在,都为原子结构理论的发展作出了巨大贡献 |
下列化学肥料均属于复合肥料的是( )。
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |