题目内容
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。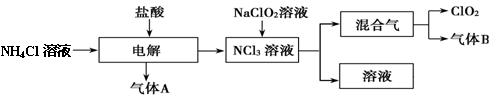
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和监测及警报装置 |
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
(1)不是 C
(2) A、B、C 、D
(3)2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O
(4)2NaClO2+Cl2=2NaCl+2ClO2 安全性好,没有产生毒副产品
(5)H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O 反应过程中生成的二氧化碳起到稀释作用
解析

(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
2013年度诺贝尔化学奖再次授予计算化学领域的科学家。以下基于结构理论进行繁难计算得出的是
| A.天然气的热值 | B.合成氨的原子利用率 |
| C.尿素的含氮量 | D.p轨道电子云的形状 |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。 下列使用化肥、农药的描述中正确的是( )
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |
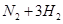


 。
。



 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。