题目内容
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: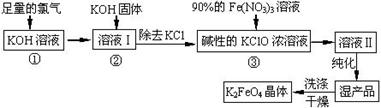
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(7)如何判断K2FeO4晶体已经洗涤干净 。
(15分)
(1)温度较低 (1分)
(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)
(3)Fe元素的化合价显+6价,易得电子(1分)
(4)10 mol/L (2分)
(5)AC (2分)
(6)KNO3 KCl, (2分)
KNO3可用于化肥,炸药等 (答1点即得1分)
2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl-+ 5H2O (2分)
(7)取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净。(2分)
解析试题分析:(1)该生产工艺反应①应在较低温度下进行,因为后面会用到KClO溶液;
(2)工业上制取Cl2,是通过电解饱和食盐水的方法,化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑;
2NaOH + H2↑ + Cl2↑;
(3)K2FeO4具有强氧化性的原因是Fe元素的化合价显+6价,易得电子,具有强氧化性;
(4)溶液的质量是100+61.6=161.6g,则溶液的体积为161.6g/1.47g/mL=110mL=0.11L,溶质的物质的量是61.6g/56g/mol=1.1mol,所以溶液的物质的量浓度为1.1mol/0.11L=10mol/L;
(5)反应①中通入过量的氯气,所以氯气有剩余,加入氢氧化钾固体与过量的氯气反应,生成更多的KClO,为下一步反应提供反应物;所以答案选AC;
(6)反应③中硝酸铁与次氯酸钾发生氧化还原反应,铁离子被氧化为FeO42- ,次氯酸根离子被还原为氯离子,所以从“反应液II”中分离出K2FeO4后,还会有副产品KNO3、KCl,其中KNO3可用于化肥,炸药等;根据分析,反应③中发生的离子反应方程式为2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl-+ 5H2O;
(7)生成K2FeO4的同时还有氯化钾生成,所以判断K2FeO4晶体是否洗涤干净就是判断洗涤液中是否含有氯离子,判断方法是取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净。
考点:考查的工业流程的分析,工业制氯气的方法,物质氧化性的判断,判断K2FeO4晶体洗涤干净的方法

(1)下列化肥属于氮肥的是__________。
| A.NH4Cl | B.KCl | C.(NH4)2SO4 | D.K2SO4 |
H.NH4HCO3 I.草木灰
(2)上述化肥中,不能跟草木灰等碱性肥料混合施用的是____________。
下列化学工业有关设备、原料、反应条件配套的是
| A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收CO2 |
| B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000-5000 ℃ |
| C.合成氨:沸腾炉、焦炭、铁触媒、5000℃ |
| D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000℃ |
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。 下列使用化肥、农药的描述中正确的是( )
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |