题目内容
化工厂的设计是将实验室的研究成果转化为工业化生产的重要的基础工作。
(1)以硫铁矿为原料生产硫酸需经过 、 和 三个主要生产阶段。
(2)侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下: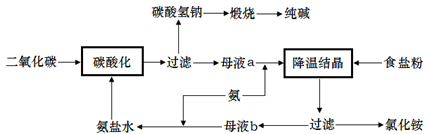
①索尔维制碱法的原理是 。(用化学方程式表示)
②侯氏制碱法与索尔维制碱法相比,优点是 。
③侯氏制碱法可以循环使用的物质有 。
(3)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(1)二氧化硫炉气的制造、二氧化硫的催化氧化、三氧化硫的吸收
(2)①NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
②侯氏制碱法的工艺由制碱和制氯化铵两个过程组成,形成纯碱与氯化铵的循环
③CO2、NaCl
(3)用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。防止H2与C12混合发生爆炸,同时防止C12-进入阴极室,这样可以获得纯净的NaOH。
解析试题分析:(1)以硫铁矿为原料生产硫酸需经过硫铁矿的煅烧,二氧化硫炉气的制造、二氧化硫气体的催化氧化、产生的三氧化硫的吸收和硫酸的生成这三个主要生产阶段。(2)①索尔维制碱法的原理是先向饱和的食盐水中通入足量的氨气,然后在通入足量的二氧化碳气体,这时发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl. 将NaHCO3过滤出来,洗涤干净,然后加热使其发生分解反应:2NaHCO3 Na2CO3+H2O+CO2↑。即得到了纯碱Na2CO3。②侯氏制碱法与索尔维制碱法相比,优点是侯氏制碱法的工艺由制碱和制氯化铵两个过程组成,形成了纯碱与氯化铵的循环利用,减少了价值不大的CaCl2的生成。③有流程示意图可看出侯氏制碱法可以循环使用的物质有CO2、NaCl。(3)海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是防止阴极室的H2与阳极室C12混合发生爆炸,同时防止C12-进入阴极室,这样可以获得纯净的烧碱——NaOH。
Na2CO3+H2O+CO2↑。即得到了纯碱Na2CO3。②侯氏制碱法与索尔维制碱法相比,优点是侯氏制碱法的工艺由制碱和制氯化铵两个过程组成,形成了纯碱与氯化铵的循环利用,减少了价值不大的CaCl2的生成。③有流程示意图可看出侯氏制碱法可以循环使用的物质有CO2、NaCl。(3)海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是防止阴极室的H2与阳极室C12混合发生爆炸,同时防止C12-进入阴极室,这样可以获得纯净的烧碱——NaOH。
考点:考查硫酸的生成过程、侯氏制碱法与索尔维制碱法的原理及优缺点、海水的净化、氯碱工业操作应该注意的问题等知识。

下列化学工业有关设备、原料、反应条件配套的是
| A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收CO2 |
| B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000-5000 ℃ |
| C.合成氨:沸腾炉、焦炭、铁触媒、5000℃ |
| D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000℃ |
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,下列物质中 可以作为气体A的代用品(填编号)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
化学工业是国民经济的支柱产业。下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 |
| B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 |
| D.炼油厂用分馏法生产汽油 |



 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。