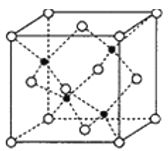
题目内容
【题目】I.由三种元素组成的化合物 A,按如下流程进行实验。气体 B 为纯净物,溶液D焰色反应为黄色。
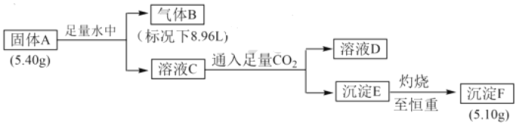
请回答:
(1)组成A的三种元素是____,A 的化学式是_____。
(2)固体A与H2O反应的化学方程式是______。
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式_____。
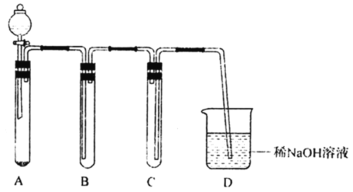
II.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。某小组按照以下实验装置制备ClO2并验证其某些性质。请回答下列问题:
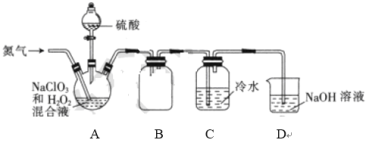
(1)通入氮气的主要作用有2个,分别是____;
(2) A中的硫酸有时也可以用浓盐酸代替, 实验过程中同时还大量生成另一种有色气体单质, 写出化学方程式:_____。
【答案】Na、Al、H NaAlH4 NaAIH4+2H2O=NaAlO2+4H2↑ 3NaH+Fe2O3=2Fe +3NaOH 一是可以起到搅拌作用,二是氮气保护, 稀释ClO2的浓度,防止爆炸 2NaClO3+4HC1=2NaCl+Cl2↑+2ClO2↑+2H2O
【解析】
Ⅰ.根据题干信息可知,气体B为纯净物,溶液D焰色反应为黄色,说明溶液D中含有Na元素,则A中含有Na元素,结合物质转化关系分析,A与水反应生成B和C,C与足量的CO2可生成溶液D和沉淀E,则A为NaAlH4,A与H2O发生反应NaAIH4+2H2O=NaAlO2+4H2↑,则B为H2,C为NaAlO2溶液,D为Na2CO3溶液,E为Al(OH)3沉淀,F为Al2O3,5.4g NaAlH4物质的量为0.1mol,5.1g Al2O3物质的量为0.05mol,所以转化过程中铝元素物质的量守恒,符合题意;据此分析解答问题;
Ⅱ.该实验为制备ClO2并验证其某些性质的实验,A为NaClO3和H2O2在酸性条件下制备ClO2的装置,B为防倒吸装置,C为验证ClO2是否溶于水,D为尾气处理装置,据此分析解答。
Ⅰ.(1)根据上述分析可知,A的化学式为NaAlH4,组成A的三种元素是Na、Al、H;
(2)固体A与H2O反应生成H2和NaAlO2,反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑;
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),则甲为NaH,脱锈过程中发生反应的化学方程式为3NaH+Fe2O3=2Fe +3NaOH;
Ⅱ.(1)由于ClO2与空气混合时,在混合气体中的体积分数大于10%就可能发生爆炸,通入氮气既可以起到搅拌作用,又可以作保护气,稀释ClO2的浓度,防止爆炸;
(2)A中的硫酸有时也可以用浓盐酸代替,实验过程中同时还大量生成另一种黄绿色气体Cl2,发生的化学方程式为2NaClO3+4HC1=2NaCl+Cl2↑+2ClO2↑+2H2O。