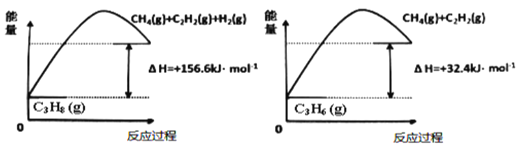
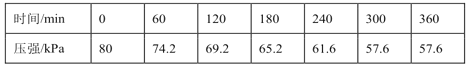
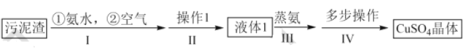
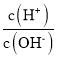题目内容
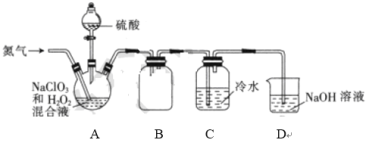
【题目】下图是用KClO3与浓盐酸反应制取氯气的简易装置。下列说法正确的是
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的为除去HCl
【答案】B
【解析】
A. 浓盐酸与二氧化锰在常温下不反应;
B. 用KClO3与浓盐酸反应,生成氯化钾、氯气和水;
C. 反应得到的产物为KCl,项其中加入足量的AgNO3,生成AgCl,如盐酸过量,与AgNO3反应也生成沉淀;
D. B装置用于收集氯气。
A. 用浓盐酸和高锰酸钾、重铬酸钾均能发生反应是被HCl,但浓盐酸与二氧化锰在常温下不反应,因此不能使用该装置,A项错误;
B. 用KClO3与浓盐酸反应,生成氯化钾、氯气和水,反应方程式为:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,B项正确;
C. 反应得到的产物为KCl,项其中加入足量的AgNO3,生成AgCl,如盐酸过量,与AgNO3反应也生成沉淀,因此不能利用沉淀质量可求出剩余盐酸的量,C项错误;
D. B装置用于收集氯气,D项错误;
答案选B。

练习册系列答案
相关题目