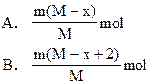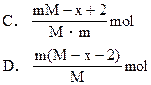题目内容
短周期元素A、B、C、D、E的原子序数依次增大,A与D、C与E位于同一主族。D原子的内层电子总数是其最外层电子数的2.5倍,且D 的原子序数为A、C原子序数之和。下列叙述中正确的是( )
A. BC2、DC2、EC2的化学键类型和晶体类型都相同
B. AC2、AE2分子中所有原子最外层都满足8电子稳定结构
C.液态化合物AE2在足量氧气中燃烧,气体体积减少(相同状况)
D.EC2通入BaCl2溶液无任何现象,继续通入BC2也无沉淀生成
A. BC2、DC2、EC2的化学键类型和晶体类型都相同
B. AC2、AE2分子中所有原子最外层都满足8电子稳定结构
C.液态化合物AE2在足量氧气中燃烧,气体体积减少(相同状况)
D.EC2通入BaCl2溶液无任何现象,继续通入BC2也无沉淀生成
B
该题突破口为D原子内层电子数是其最外层电子数的2.5倍,且为短周期元素,推知D为Si。A、D同主族,则A为C。又知D的原子序数为A、C原子序数之和,则C为O,C与E同主族,E为S。由A、B、C、D、E原子序数依次增大;确定B为N。其相应化合物,SiO2为原子晶体;A错。CO2、CS2所有原子均满足8电子稳定结构;B正确。同状况下液态CS2在足量氧气中燃烧方程式CS2(L)+3O2(g)=CO2(g)+2SO2(g)知,反应前后气体体积不变;D项,SO2通入BaCl2溶液无任何现象,再通入NO2,会有BaSO4白色沉淀生成;C、D错。∴选B。

练习册系列答案
相关题目
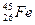 原子,有关
原子,有关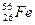 互为同素异形体
互为同素异形体