题目内容
几种短周期元素的原子半径及其某些化合价见下表:
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是 。
(4)DB2的结构式 。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式: 。
| 元素代号 | A | B | D | E | G | H | I | J |
| 常见化合价 | -1 | -2 | +4、-4 | +6、+4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/pm | 64 | 66 | 77 | 104 | 110 | 143 | 160 | 186 |
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是 。
(4)DB2的结构式 。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式: 。
(1)第三周期,ⅥA;
(2)F- >Na+ >Al3+
(3)离子晶体;
(4)O="C=O " ;
(5)CO2 + OH- =H CO3-
本题考查物质结构与元素周期表。从数据分析,B和E位于ⅥA族,且B是氧元素,E是硫元素,D位于ⅣA族,为碳元素,A位于ⅦA族,半径小于B,为氟元素,G在ⅤA族,半径大于E,为磷元素,H位于ⅢA族,半径大于H,为铝元素,同理可知,I是镁元素,J是钠元素。(3)A与J所形成的化合物为NaF,是离子晶体;(4)DB2是CO2;(5)D的最高价氧化物是CO2,X是NaOH,方程式为:CO2 + OH-=HCO3-。

练习册系列答案
相关题目
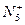 的盐类。Christe指出:
的盐类。Christe指出: 更强的氧化剂,跟水和有机物反应均发生爆炸。下列叙述错误的是( )
更强的氧化剂,跟水和有机物反应均发生爆炸。下列叙述错误的是( )