题目内容
某温度时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
试回答下列问题
(1)该温度时,反应的平衡常数k=
(2)若保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)= mol
(3)若保持其他条件不变,向上表中的平衡体系再通0.60molH2O,新平衡时H2O的体积分数为 .
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| 20 | 0.80 | |
| 40 | 0.20 |
(1)该温度时,反应的平衡常数k=
(2)若保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=
(3)若保持其他条件不变,向上表中的平衡体系再通0.60molH2O,新平衡时H2O的体积分数为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)利用三段式可计算出各成分平衡时的物质的量,再求得浓度,算出平衡常数;
(2)温度不变,平衡常数不变,利用平衡常数可求得平衡时的浓度,进而求得物质的量;
(3)温度不变,平衡常数不变,利用平衡常数可求得平衡时的浓度,进而求得物质的量,利用体积之比等于物质的量之比,确定体积分数.
(2)温度不变,平衡常数不变,利用平衡常数可求得平衡时的浓度,进而求得物质的量;
(3)温度不变,平衡常数不变,利用平衡常数可求得平衡时的浓度,进而求得物质的量,利用体积之比等于物质的量之比,确定体积分数.
解答:
解:(1)H2O(g)+CO(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始 0.3mol/L 0.6mol/L 0 0
20min 0.1mol/L 0.4mol/l 0.2mol/l 0.2mol/l
40min 0.1mol/L 0.4mol/l 0.2mol/l 0.2mol/l
根据以上数据可知,在20min 是反应就已经处于平衡状态,则K=
=
=1,故答案为:1;
(2)设平衡时生成二氧化碳浓度为xmol/L
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始(mol/L) 0.6 0.3 0 0
转化(mol/L) x x x x
平衡(mol/L) 0.6-x 0.3-x x x
根据K=
=1,解得x=0.2,所以n(CO2)=0.2×2mol=0.4mol,故答案为:0.4;
(3)设平衡时转化的水为xmol/L
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始(mol/L) 0.6 0.6 0 0
转化(mol/L) x x x x
平衡(mol/L) 0.6-x 0.6-x x x
根据K=
=1,解得x=0.3,所以H2O的体积分数为
=0.25,故答案为:0.25.
 CO2(g)+H2(g)
CO2(g)+H2(g)初始 0.3mol/L 0.6mol/L 0 0
20min 0.1mol/L 0.4mol/l 0.2mol/l 0.2mol/l
40min 0.1mol/L 0.4mol/l 0.2mol/l 0.2mol/l
根据以上数据可知,在20min 是反应就已经处于平衡状态,则K=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.2×0.2 |
| 0.1×0.4 |
(2)设平衡时生成二氧化碳浓度为xmol/L
H2O(g)+CO(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)初始(mol/L) 0.6 0.3 0 0
转化(mol/L) x x x x
平衡(mol/L) 0.6-x 0.3-x x x
根据K=
| x×x |
| (0.6-x)×(0.3-x) |
(3)设平衡时转化的水为xmol/L
H2O(g)+CO(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)初始(mol/L) 0.6 0.6 0 0
转化(mol/L) x x x x
平衡(mol/L) 0.6-x 0.6-x x x
根据K=
| x×x |
| ( 0.6-x)×(0.6-x) |
| 0.6-0.3 |
| 0.6-0.3+0.6-0.3+0.3+0.3 |
点评:本题主要考查化学平衡常数计算以及应用平衡常数计算平衡时有关物质的物质的量和体积分数,解题关键是要抓住温度不变化学平衡常数也不变,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
图为部分短周期元素的原子半径及主要化合价,根据图中信息,判断以下叙述正确的是( )


| A、R形成的化合物中常见-1、+1、+5、+7价 |
| B、Z最高价氧化物对应的水化物属于弱电解质中的弱碱 |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、X与Y形成的化合物为离子化合物,也为碱性氧化物 |
下列叙述正确的是( )
| A、1mol任何气体的体积都为22.4L |
| B、1mol任何物质在标准状况下所占的体积都为22.4L |
| C、标准状况下,1mol水所占的体积都为22.4L |
| D、标准状况下,22.4L的任何气体的物质的量都是1mol |
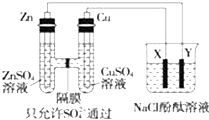 按如图所示装置连接,X、Y均为惰性电极.请回答下列问题:
按如图所示装置连接,X、Y均为惰性电极.请回答下列问题: