题目内容
4.NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O
(1)上述反应中氧化剂是NaNO2.
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤冰醋酸,你认为必须选用的物质有①②⑤(填序号).
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是B(填编号).
A.NaCl B.NH4Cl
C.HNO3 D.浓H2SO4
(4)根据氧化还原反应得失电子守恒原理将下面方程式补充完整:
□Al+□NaNO3+□NaOH═□NaAlO2+□N2↑+2H2O.
(5)若(4)反应过程中转移10mol e-,则生成标准状况下N2的体积为22.4L.
分析 (1)反应中N元素的化合价降低,I元素的化合价升高;
(2)由2NaNO2+4HI═2NO↑+I2+2NaI+2H2O可知,鉴别NaNO2和NaCl,可利用碘的特性分析;
(3)NaNO2具有氧化性,能使NaNO2转化为不引起二次污染的N2的物质应具有还原性;
(4)Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,根据化合价升降相等配平;
(5)由电子守恒及原子守恒进行计算.
解答 解:(1)反应中N元素的化合价降低,I元素的化合价升高,则氧化剂是NaNO2,故答案为:NaNO2;
(2)由2NaNO2+4HI═2NO↑+I2+2NaI+2H2O可知,KI与NaNO2反应生成I2须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,所以鉴别NaNO2和NaCl,应该选择:①水、②碘化钾淀粉试纸、⑤食醋,
故答案为:①②⑤;
(3)NaNO2具有氧化性,能使NaNO2转化为不引起二次污染的N2的物质应具有还原性,只有选项B符合,故答案为:B;
(4)Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,该反应还应生成水,由电子守恒及原子守恒可知,反应的化学方程式为10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O,
故答案为:10;6;4;10;3;
(5)若(4)反应过程中转移10mole-,N元素的化合价由+5价降低为0,则转移10mole-,生成标准状况下N2的体积为:$\frac{10mol}{5-0}$×$\frac{1}{2}$×22.4L/mol=22.4L,
故答案为:22.4.
点评 本题考查较综合,涉及氧化还原反应、配平,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应及能量变化的考查,注意从元素化合价角度及图象角度分析,题目难度中等.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 0.1g | B. | >0.1g | C. | <0.1g | D. | 无法确定 |
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 二者在一定条件下可相互转化 | |
| D. | 与盐酸反应得到等质量CO2,用NaHCO3质量比Na2CO3要多 |
| A. | ($\frac{b}{A}$)(A-N)mol | B. | ($\frac{b}{A}$)(A-N+m)mol | C. | $\frac{b}{A+m}$(A-N)mol | D. | $\frac{b}{A+m}$(A-N+m)mol |
①升高温度
②增加浓度
③增大压强
④使用催化剂.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ①③④ |
| A. | NaCl | B. | BaCl2 | C. | MgCl2 | D. | AlCl3 |
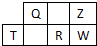 短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )| A. | Q、Z、W可形成三原子直线型分子 | |
| B. | Z、R两元素气态氢化物的沸点:R>Z | |
| C. | Z、Q两元素的气态氢化物中键能大小:Z>Q | |
| D. | T、W两元素组成的化合物不能通过水溶液中的离子反应制取 |
| A. | 使用脱硫煤和汽车尾气净化器,均可减少二氧化碳的排放 | |
| B. | 以治理细颗粒物(PM2.5)和可吸入颗粒物(PM10)为突破口,抓住能源效率、尾气排放和扬尘等关键环节,深入实施大气污染防治行动计划 | |
| C. | 电子垃圾统一回收、拆解、再利用,能够减少对土壤和水源的污染 | |
| D. | 加快淘汰钢铁、水泥、平板玻璃、电解铝等行业的落后产能 |
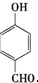 .有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
.有人提出,以对甲基苯酚为原料合成PHBA的途径如下: $→_{①}^{(CH_{3})SO_{4}/OH-}$
$→_{①}^{(CH_{3})SO_{4}/OH-}$ $→_{②}^{Cl_{2}/光照}$C$→_{③}^{NaOH溶液/加热}$D$\stackrel{O_{2}、Cu/加热}{→}$EPHBA
$→_{②}^{Cl_{2}/光照}$C$→_{③}^{NaOH溶液/加热}$D$\stackrel{O_{2}、Cu/加热}{→}$EPHBA
 .
.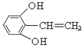 或
或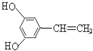 (只写一种).
(只写一种).