题目内容
【题目】(一)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。
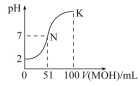
(1)由图中信息可知HA为____________酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7,用离子方程式表示其原因_________________,此时,溶液中水电离出的c(OH-)=__________mol·L-1。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_____________________
(4)K点所对应的溶液中,c(M+)+c(MOH)__________2c(A-)
(二)Ⅰ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 moL·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4-+5HS03-+H+= 2Mn2++5SO42-+3H2O。
请完成下列问题:
(1)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)本实验________(填“需要”或“不需要”)使用指示剂,理由是___________________
Ⅱ.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol·L-1稀硫酸标准溶液。然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是________(填序号)。
A.实验中所用到的滴定管、容量瓶在使用前均需要查漏
B.若选用100 mL容量瓶配制标准酸溶液,需用密度为1.84 g·mL-1、98%的浓硫酸5.43 mL
C.容量瓶中有少量的蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大
E.若配制标准酸溶液在定容时俯视读数,则导致所测的NaOH溶液浓度偏大
F.中和滴定实验,若滴定前平视读数、滴定结束俯视读数,则导致实验结果偏大
【答案】强 < M++H2O![]() MOH+H+ 1×10-a c(M+)>c(A-)>c(OH-)>c(H+) = ADEFH 不需要 因为Mn2+无色,MnO4-紫色,过量的MnO4-使无色溶液变为紫色 ABD
MOH+H+ 1×10-a c(M+)>c(A-)>c(OH-)>c(H+) = ADEFH 不需要 因为Mn2+无色,MnO4-紫色,过量的MnO4-使无色溶液变为紫色 ABD
【解析】
(1)根据图象知,加入碱溶液的体积为0时,0.01molL1HA溶液的pH=2,氢离子浓度为0.01mol/L,氢离子浓度等于酸浓度,所以该酸在溶液中完全电离,属于强酸,
故答案为:强;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O![]() MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH)=1×10-a molL1,
MOH+H+;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH)=1×10-a molL1,
故答案为:<;M++H2O![]() MOH+H+;1×10-a;
MOH+H+;1×10-a;
(3)由于在K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02molL1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=0.002mol/0.2L=0.01mol/L,HA是强酸,所以反应后的溶液中c(A)=1/2×0.01molL1=0.005molL1,故c(M+)+c(MOH)=2c(A),
故答案为:=。
(二)Ⅰ.(1)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,无色NaHSO3溶液显酸性,用酸式滴定管,滴定过程还需要锥形瓶盛放待测液、白纸对比终点颜色变化、滴定管夹和铁架台,所以需要用到的是:A、D、E、F、H,
故答案为:ADEFH;
(2)Mn2+无色,MnO4- 为紫色,过量的MnO4-使无色溶液变为紫色,所以本实验不需要使用指示剂;
故答案为:不需要;因为Mn2+无色,MnO4-紫色,过量的MnO4-使无色溶液变为紫色;
Ⅱ.A. 容量瓶有瓶塞,配制时需要摇匀,所以使用前必须检查是否漏水;滴定管有旋塞或者橡胶管,使用前必须检查是否漏液,故A正确;
B. 若选用100 mL容量瓶配制标准酸溶液,根据稀释定律可知,需用密度为1.84 g·mL-1、98%的浓硫酸5.43 mL,故B正确;
C. 在配制溶液时,要加蒸馏水定容,所以容量瓶中含有少量蒸馏水无影响,故C错误;
D. 滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测得的NaOH溶液的浓度将偏大,故D正确;
E. 配制溶液时,定容时俯视度数,溶液体积偏小,根据c=n/V可知浓度偏大,故E错误;
F. 中和滴定时,若在最后一次读数时俯视读数,则消耗的标准溶液体积偏小,则测得的NaOH溶液的浓度将偏小,故F错误;
故答案为:ABD。

【题目】某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。
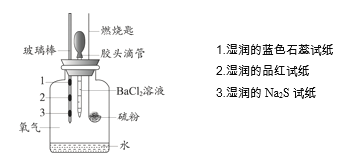
下列实验事实与所得结论相符的是
实验事实 | 所得结论 | |
A | 湿润的品红试纸褪色 | 证明硫燃烧的产物中有SO2 |
B | 湿润的Na2S试纸上出现淡黄色固体 | 证明硫的燃烧产物能被还原成硫 |
C | 湿润的蓝色石蕊试纸变红 | 证明硫的燃烧产物中有酸类物质 |
D | 加入BaCl2溶液产生白色沉淀 | 证明硫燃烧的产物中有SO3 |
A.AB.BC.CD.D