题目内容
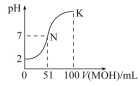
【题目】某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示:
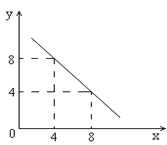
(1)该温度下水的离子积为__________;该温度_____________常温(填“高于”、“低于”或“等于”)。
(2)该温度下0.01 mol/L NaOH溶液的pH为_____。
(3)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性:![]() 。则该温度下,0.01mol/L盐酸的酸度AG=_________。
。则该温度下,0.01mol/L盐酸的酸度AG=_________。
【答案】(1)10-12高于 (2)10 (3)8
【解析】
(1)根据图像可x=4时,y=8,所以该温度下水的离子积常数是10-4·10-8=10-12>10-14,所以温度高于常温。
(2)0.01 mol/L NaOH溶液中OH-的浓度是0.01 mol/L,所以氢离子的浓度![]()
,因此pH=10。
(3)0.01mol/L盐酸溶液中氢离子浓度是0.01 mol/L,所以OH-的浓度是10-10mol/L。因此该温度下,0.01mol/L盐酸的酸度![]() =8。
=8。

练习册系列答案
相关题目