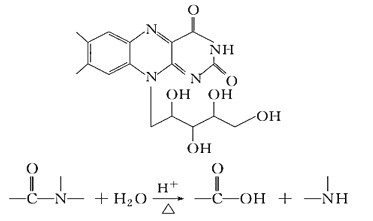
题目内容
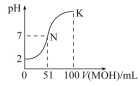
【题目】如图电化学原理可用于治理水中硝酸盐的污染,下列说法不正确的是
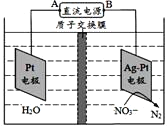
A. A为电源正极
B. 在Pt电极上发生氧化反应
C. 阴极电极反应式为2NO3-+6H2O+10e-=N2+12OH
D. 质子从Pt电极移向Ag-Pt电极
【答案】C
【解析】
A.根据图知,电解槽右边部分N元素化合价由+5价变为0价,所以硝酸根离子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,所以A是正极,故A正确;
B.Pt电极为阳极,发生氧化反应,故B正确;
C.阴极上硝酸根离子得电子发生还原反应,氢离子通过质子交换膜进入右侧,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故C错误;
D.质子向阴极移动,所以质子从Pt电极移向Ag-Pt电极,故D正确。
故答案为C。

练习册系列答案
相关题目