题目内容
【题目】在常温下,向20 mL浓度均为0.1 mol·L1的盐酸和氯化铵混合溶液中滴加0.1 mol·L1的氢氧化钠溶液,溶液pH随氢氧化钠溶液加入体积的变化如图所示(忽略溶液体积变化)。下列说法正确的是
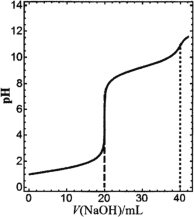
A.V(NaOH)=20 mL时,2n(![]() )+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
)+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
B.V(NaOH)=40 mL时,c(![]() )<c(OH)
)<c(OH)
C.当0<V(NaOH)<40 mL时,H2O的电离程度一直增大
D.若改用同浓度的氨水滴定原溶液,同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要小
【答案】B
【解析】
A. V(NaOH)=20 mL时,溶液中的溶质为0.02mol氯化钠和0.02mol氯化铵,电荷守恒有n(Na+)+n(H+)+ n(![]() )=n(Cl-)+n(OH),因为n(Na+)=0.02mol,n(Cl-)=0.04mol,所以有n(H+)+ n(
)=n(Cl-)+n(OH),因为n(Na+)=0.02mol,n(Cl-)=0.04mol,所以有n(H+)+ n(![]() )=0.02+n(OH),物料守恒有n(Cl-)= n(Na+)+ n(
)=0.02+n(OH),物料守恒有n(Cl-)= n(Na+)+ n(![]() )+n(NH3·H2O),即0.02= n(
)+n(NH3·H2O),即0.02= n(![]() )+n(NH3·H2O),所以,2n(
)+n(NH3·H2O),所以,2n(![]() )+n(NH3·H2O)+n(H+)=0.04 mol+n(OH),故错误;
)+n(NH3·H2O)+n(H+)=0.04 mol+n(OH),故错误;
B. V(NaOH)=40 mL时,溶质为0.04mol氯化钠和0.02mol一水合氨,溶液显碱性,因为水也能电离出氢氧根离子,故c(![]() )<c(OH)正确;
)<c(OH)正确;
C. 当0<V(NaOH)<40 mL过程中,前20毫升氢氧化钠是中和盐酸,水的电离程度增大,后20毫升是氯化铵和氢氧化钠反应,水的电离程度减小,故错误;
D. 盐酸和氢氧化钠反应生成氯化钠溶液,为中性,若改用同浓度的氨水滴定原溶液,盐酸和氨水反应后为氯化铵的溶液仍为酸性,所以同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要大,故错误。
故选B。