题目内容
16.下列溶液,一定呈中性的是( )| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | pH=pOH的溶液(pOH是OH-浓度的负对数) | |
| C. | pH=14-pOH的溶液 | |
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
分析 溶液一定呈中性,说明溶液中c(H+)=c(OH-),不能根据pH、氢离子或氢氧根离子浓度大小判断溶液酸碱性,据此分析解答.
解答 解:A.c(H+)=1×10-7mol/L的溶液可能呈酸性、碱性或中性,如果c(H+)=c(OH-),则溶液呈中性,如果c(H+)>c(OH-),则溶液呈酸性,如果c(H+)<c(OH-),则溶液呈碱性,故A错误;
B.pH=pOH的溶液(pOH是OH-浓度的负对数),说明溶液中存在c(H+)=c(OH-),则溶液呈中性,故B正确;
C.pH=14-pOH的溶液可能呈酸性、碱性或中性,要根据c(H+)、c(OH-)的相对大小判断,故C错误;
D.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液,如果酸是强酸,则溶液呈中性,如果酸是弱酸,则溶液呈碱性,故D错误;
故选B.
点评 本题考查溶液酸碱性判断,溶液酸碱性要根据c(H+)、c(OH-)的相对大小判断,温度未知时不能根据pH与7的相对大小判断,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:2,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
7.如表是元素周期表的一部分,请回答有关问题(用化学用语答题):
(1)表中金属性最强的元素,其原子结构示意图为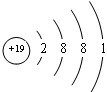 .
.
(2)表中某元素能形成两性氢氧化物,写出该两性氢氧化物与⑨的最高价氧化物的水化物反应的离子方程式(OH)3+OH-=AlO2-+2H2O.
(3)④元素与③元素形成化合物的电子式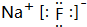 .
.
(4)下列说法正确的是E
A.元素④比⑤的金属性强,是因为④在反应中失去的电子数比⑤少
B.③、⑥、⑦三种元素中,③的最高价氧化物的水化物的酸性最强
C.⑦的氢化物的水溶液酸性比⑥强,说明元素⑦的非金属性强
D.晶体⑧在熔化过程中需破坏化学键
E.元素⑦可用于制有机农药,但其难降解、高残留,现在已逐渐被其他农药取代.
(5)⑦元素与⑩元素两者核电荷数之差是18.
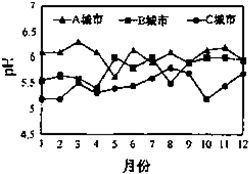
(6)汽车尾气中含有①、②元素的氧化物等有害气体,他们也是造成酸雨危害的主要原因之一.A、B、C三城市全年雨水的月平均pH变化如图2所示,
①受酸雨危害最严重的是:C城市;
②写出由元素②的一种红棕色气体形成酸雨的离子方程式:3NO2+H2O=2H++2NO3-+NO;
③汽车安装尾气催化净化装置,可将上述混合气体转化为无害气体排放,降低对环境的污染.写出该反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.催化剂的作用是:加快反应速率.
| 1 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中某元素能形成两性氢氧化物,写出该两性氢氧化物与⑨的最高价氧化物的水化物反应的离子方程式(OH)3+OH-=AlO2-+2H2O.
(3)④元素与③元素形成化合物的电子式
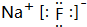 .
.(4)下列说法正确的是E
A.元素④比⑤的金属性强,是因为④在反应中失去的电子数比⑤少
B.③、⑥、⑦三种元素中,③的最高价氧化物的水化物的酸性最强
C.⑦的氢化物的水溶液酸性比⑥强,说明元素⑦的非金属性强
D.晶体⑧在熔化过程中需破坏化学键
E.元素⑦可用于制有机农药,但其难降解、高残留,现在已逐渐被其他农药取代.
(5)⑦元素与⑩元素两者核电荷数之差是18.
(6)汽车尾气中含有①、②元素的氧化物等有害气体,他们也是造成酸雨危害的主要原因之一.A、B、C三城市全年雨水的月平均pH变化如图2所示,
①受酸雨危害最严重的是:C城市;
②写出由元素②的一种红棕色气体形成酸雨的离子方程式:3NO2+H2O=2H++2NO3-+NO;
③汽车安装尾气催化净化装置,可将上述混合气体转化为无害气体排放,降低对环境的污染.写出该反应的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.催化剂的作用是:加快反应速率.

4.一定质量的下列有机物在氧气中完全燃烧,生成二氧化碳质量与碳原子数无关的是( )
| A. | 环烷烃 | B. | 醇类 | C. | 炔烃 | D. | 油脂 |
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
8.常温下,向20 mL 0.01 mol•L-1 HA溶液中逐滴加入 0.01 mol•L-1 MOH溶液过程中,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法中错误的是( )
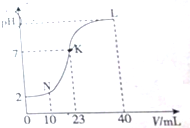

| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
5.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
6.若发现了116号元素,并知它是第ⅥA族元素,则下列说法中不正确的是( )
| A. | 其钠盐的化学式为Na2X | B. | 最高价氧化物对应水化物为碱 | ||
| C. | X是金属元素 | D. | X单质是能导电的固体 |