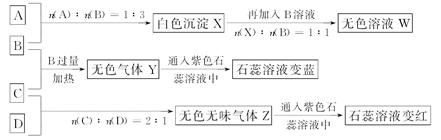
题目内容
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-) |
| D.硫化钠溶液中,C (Na+) =" 2" C (S2-) |
C
解析试题分析:氨水中存在电离平衡,稀释促进电离,所以相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是小于2∶1,A不正确;氯化铵是强酸弱碱盐,NH4+水解,因此1mol/L NH4Cl溶液中 C(NH4+)< C(Cl-),B不正确;C中根据电荷守恒可知,C (Na+)+C(H+)=C(OH-)+C (CH3COO-),溶液显中性,则C(H+)=C(OH-),所以C (Na+) =" C" (CH3COO-),选项C正确;硫化钠溶于水,S2-水解,则根据物料守恒可知,C (Na+)=2 C (S2-)+2 C (HS-)+2 C (H2S),选项D不赀之器,答案选C。
考点:考查弱电解质的电离、盐类水解以及离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确有关原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合题意灵活运用即可。

(双选)下列溶液中微粒浓度关系一定正确的是
| A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) |
| B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)> c(OH-) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列各溶液中,微粒的物质的量浓度关系错误的是
| A.0.1 mol·L-1 NH4Cl溶液:c(NH4+)<c( Cl-) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c( Cl-)=c(CH3COOH) |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液 ,pH=7,c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
室温下,往0.1mol/L的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是
| A.往溶液中滴入稀硫酸 | B.往溶液中加入NH4Cl晶体 |
| C.把溶液加热至沸腾 | D.往溶液中加入NaOH固体 |
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)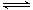 N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:
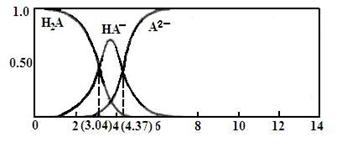
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。