��Ŀ����
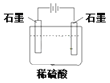
����Ŀ��(1)�ֱ�ȡ40 mL 0.50 mol/L������0.55 mol/L NaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�

�ش��������⣺�������������������Һ���ܶȶ���1 g/cm3����֪�кͺ�������Һ�ı�����c=4.18 J/(g����)��ʵ��ʱ�����������������_______________��
A.��Ӧǰ������Һ���¶� B.��Ӧǰ������Һ������
C��Ӧǰ����������Һ���¶� D.��Ӧǰ����������Һ������
E.��Ӧ������Һ������¶� F.��Ӧ������Һ������
(2)ijѧ��ʵ���¼�������£�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | �������� | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к���Ϊ��H=____________��
(3)�ٶ���ѧ���IJ�����ȫͬ�ϣ�ʵ���и���100 mL0.50 mol/L�����100 mL 0.55 mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������___(��������������������)�����к���___________________(��������������������)
(4)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к�����ֵ��__________(����ƫ��������ƫС��������Ӱ����)����40 mL0.50 mol/LNaOH��Һ��������ʵ�飬��õ��к�����ֵ��__________��(����ƫ��������ƫС��������Ӱ����)
(5)����ʵ������57.3 kJ/mol(�������к��ȵ�ֵ)��ƫ�����ƫ���ԭ�������(����ĸ)___________��
a.ʵ��װ�ñ��¡�����Ч����
b.���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������Һ���¶�
c.����Ͳ��ȡ������Һ�����ʱ���Ӷ���
d.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ�
���𰸡�ACE -51.8 kJ/mol ����� ��� ƫС ƫС abd
��������
(1)����Q=c��m����t���������
(2)���ݡ�H=-Q=-c��m����t���м��㣻
(3)���ݷ�Ӧ�ų��������뷴Ӧ�����ʶ��ٳ����ȷ���������к��ȸ����жϣ�
(4)һˮ�ϰ���������ʣ���������������������ȫ��Ӧ�ų������Ȳ���ȫ��Ӧ�ų������ࣻ
(5)a��ʵ��װ�ñ��¡�����Ч������ã�
b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�Ҫ���¶ȼƻ���ֵ�ٲⶨH2SO4��Һ���¶ȣ�
c����ȡNaOH��Һ�����ʱ����Ҫ�Ͱ�Һ����ƽ��
d������Ͼ����ܼ���ʵ�������������ʧ��
(1)��Q=c��m����t��֪���ⶨ�к�����Ҫ�ⶨ������Ϊ��
A.��Ӧǰ���������������Һ���¶ȣ�C.��Ӧǰ����������Һ���¶ȣ�E.��Ӧ������Һ������¶ȣ��ʺ���ѡ����ACE��
(2)��1��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.05�棬��Ӧ���¶�Ϊ��23.2�棬��Ӧǰ���¶Ȳ�Ϊ3.15�棻
��2��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.3�棬��Ӧ���¶�Ϊ��23.4�棬��Ӧǰ���¶Ȳ�Ϊ3.1�棻
��3��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.55�棬��Ӧ���¶�Ϊ��23.6�棬��Ӧǰ���¶Ȳ�Ϊ��3.05�棻
ƽ���¶Ȳ�Ϊ��3.1�棬40 mL��0.50 mol/L������40 mL 0.55 mol/L����������Һ��������Ϊm=80 mL��1 g/cm3=80 g��c=4.18 J/(g����)�����빫ʽ-Q=c��m����t�ɼ��������0.02 mol��ˮ�ų�����Q=4.18 J/(g����)��80 g��3.1��=1036.64 J=1.036 kJ����������1 mol��ˮ�ų�����Ϊ��1.036 kJ��![]() =51.8 kJ������ʵ���õ��к��ȡ�H=-51.8 kJ/mol��
=51.8 kJ������ʵ���õ��к��ȡ�H=-51.8 kJ/mol��
(3)�����õ���������ʵ������ٲ�ͬ�����Է�Ӧ�ų���������ͬ���������к�����ǿ�ᡢǿ����ȫ��Ӧ�����������κ�1 molH2Oʱʱ�ų�����������֪�к�������ȵģ�
(4)��ˮ�е�һˮ�ϰ���һԪ������������������ʹ�ò�õ��к�����ֵ��ƫС�����������ܲ��㣬���õ��к��ȿ��ܻ�ƫС��
(5) a.ʵ��װ�ñ��¡�����Ч�������õ�����������ʹ�ⶨ�к�����ֵƫС��a�������⣻
b.���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������Һ���¶������������ᷴӦ������ɢʧ�����Ի�ƫС��b�������⣻
c.�к��ȵ���ֵ�ⶨ������Ϊ�����㣬����Ͳ��ȡ������Һ�����ʱ���Ӷ�������������ֵƫС���Ը��������Ϊ�������ʹ�ⶨ��ֵƫ��c���������⣻
d.�ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���������ɲ�õ��������С�����ʹ�ⶨ�к�����ֵƫС��d�������⣻
�ʺ���ѡ����abd��

����Ŀ��һ����ѧ��Ӧ�����Dz���Ҫ�������ʱ仯����Ҫ�о������仯�ͷ�Ӧ������
��1��������һ������Ȼ����ˮ��Ӧ�Ʊ������ķ�Ӧ���䷽��ʽΪ��CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)�÷�Ӧ�����������仯��ͼ��ʾ����÷�ӦΪ______��Ӧ������ȡ����ȡ�����
CO2(g)+4H2(g)�÷�Ӧ�����������仯��ͼ��ʾ����÷�ӦΪ______��Ӧ������ȡ����ȡ�����
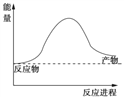
����֪���ƻ�1mol��ѧ����Ҫ���յ��������±���ʾ����÷�Ӧ���ջ�ų�����Ϊ______kJ (�ú�a b c d��ĸ�Ĵ���ʽ��ʾ)��
��ѧ�� | C��H | O��H | C=O | H��H |
����������kJ/mol�� | a | b | c | d |
��2��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ________��XΪ__________������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��______0.8mol/L������ڡ�����С�ڡ����ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ__________��
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ________��XΪ__________������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��______0.8mol/L������ڡ�����С�ڡ����ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ__________��
����Ŀ��I.�ñ�NaOH��Һ�ζ�����HCl����ƿ������£���ƿ�ݻ�ΪV L��������Ȫʵ���õ���ϡ���ᣨˮ����������ƿ���Բⶨ����ȷŨ�ȣ��÷�̪��ָʾ��������ش��������⣺
(1)�������������ʵ���Ũ��Ϊ��_____����������λ��Ч���֣�
(2)��������Ũ�ȵı�NaOH��Һ������Ϊ����ʵ������е�_____�֡�
��5.00molL��1��0.500molL��1��0.0500molL��1
(3)���������������Ũ�ȵı�NaOH��Һ�ζ����ζ�ʱʵ�������б����£�
ʵ�������� | �������������mL�� | ����NaOH��Һ�����mL�� |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
�����ִ���ϡ��������ʵ���Ũ��c��HCl��=_____�������ۼ���ֵ�Ƚϣ���ɵ�����ԭ���������Щ���в������µ�_____
�ٵζ�ǰƽ�ӣ��ζ����˸���
�ڵζ��ܣ�װ����Һ���ڵζ�ǰ���촦�����ݣ��ζ�����������
�۵ζ���������ˮϴ����δ����֪Ũ�ȵı���Һ��ϴ
�ܿ�����ɫ�仯���������� ��ϴ����ƿʱ�����ϡʳ��ˮ��������ˮ����ϴ��
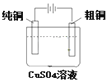
II���ⶨ�̷�FeSO4��xH2O�нᾧˮ����
��ȷ����27.8 g�̷���Ʒ�����250 mL��Һ��
����ȡ25.00 mL�����Ƶ���Һ����ƿ�У�
���������ữ��0.100 0 mol��L1 KMnO4��Һ�ζ����յ㣻
�����ظ�����3�Σ�����KMnO4��Һ������ֱ�Ϊ20.02 mL��24.98 mL��19.98 mL��
(1)�жϴﵽ�ζ��յ�ʱ��ʵ��������_____��
(2)����ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=__________��
����Ŀ������˵����ȷ����
A | B | C | D |
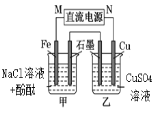
ͨ��һ��ʱ�������ȣ���Һ��pH���� | ��װ�ÿ�ʵ�� ͭ�ľ��� | �����е�K+ ����FeCl3��Һ | ���۲쵽���ձ���ʯī�缫�����ȱ�죬�����ձ���ͭ�缫Ϊ���� |
|
|
|
|
A. A B. B C. C D. D