题目内容
【题目】化学与生活、社会密切相关,下列说法不正确的是![]()
A.“地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油
B.白铁![]() 镀锌铁板
镀锌铁板![]() 比马口铁
比马口铁![]() 镀锡铁板
镀锡铁板![]() 更耐腐蚀
更耐腐蚀
C.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
D.![]() 的燃烧热是
的燃烧热是![]() ,则
,则![]() 反应的H=+2×283.0kJ/mol
反应的H=+2×283.0kJ/mol
【答案】C
【解析】
A. “地沟油”的成分是油脂,可从地沟油中提炼出油脂作为生物柴油,碱性条件下的水解反应生成肥皂,A正确;
B. 金属活动性顺序是Zn>Fe>Sn,白铁![]() 镀锌铁板
镀锌铁板![]() 破损后Zn做负极,保护铁板,马口铁破损后Fe做负极,Fe腐蚀加快,故白铁比马口铁
破损后Zn做负极,保护铁板,马口铁破损后Fe做负极,Fe腐蚀加快,故白铁比马口铁![]() 镀锡铁板
镀锡铁板![]() 更耐腐蚀,B正确;
更耐腐蚀,B正确;
C. 牺牲阳极的阴极保护法是应用原电池原理防止金属的腐蚀,C错误;
D. ![]() 的燃烧热是
的燃烧热是![]() ,表示1molCO完全燃烧生成稳定氧化物时放出热量283.0kJ,则
,表示1molCO完全燃烧生成稳定氧化物时放出热量283.0kJ,则![]() 反应的H=+2×283.0kJ/mol, D正确;
反应的H=+2×283.0kJ/mol, D正确;
故本题选C。

【题目】(1)分别取40 mL 0.50 mol/L盐酸与0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。实验时,还需测量的数据有_______________。
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(2)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为△H=____________。
(3)假定该学生的操作完全同上,实验中改用100 mL0.50 mol/L盐酸跟100 mL 0.55 mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”)所求中和热___________________(填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会__________(填“偏大”、“偏小”或“无影响”);用40 mL0.50 mol/LNaOH溶液进行上述实验,测得的中和热数值会__________。(填“偏大”、“偏小”或“无影响”)
(5)上述实验结果与57.3 kJ/mol(常温下中和热的值)有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
c.用量筒量取盐酸溶液的体积时仰视读数
d.分多次把NaOH溶液倒入盛有盐酸的小烧杯
【题目】环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
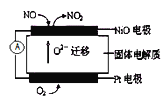
(1)连续自动监测氮氧化物![]() 的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
(2)使用稀土催化剂有效消除汽车尾气中的![]() 、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将
、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将![]() 、
、![]() 转化成无毒物质,相关反应为:
转化成无毒物质,相关反应为:
①![]()
②![]()
③![]()
则![]() ______(用
______(用![]() 和
和![]() 表示)。
表示)。
(3)实验室在恒压下,将![]() 和
和![]() 置于密闭容器中发生反应③,测得在不同温度、不同投料比时,
置于密闭容器中发生反应③,测得在不同温度、不同投料比时,![]() 的平衡转化率如下表:
的平衡转化率如下表:
投料比 | 400K | 500K | 600K |
1 |
|
|
|
2 |
|
|
|
①在![]() 与
与![]() 反应时,可提高
反应时,可提高![]() 转化率的措施有 ______填编号
转化率的措施有 ______填编号![]() 。
。
A 增加催化剂的表面积 ![]() 改用高效催化剂
改用高效催化剂 ![]() 降低温度
降低温度
D 增大压强 ![]() 分离出
分离出![]()
![]() 减小
减小![]()
②![]() 时,将投料比为1的
时,将投料比为1的![]() 和
和![]() 的混合气体共
的混合气体共![]() ,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出![]() 内,容器中
内,容器中![]() 物质的量浓度c随时间变化的曲线图______。
物质的量浓度c随时间变化的曲线图______。
(4)SNCR是一种新型的烟气脱氮环保技术,在有氧条件下,其脱氮原理是:![]() 和
和![]() 在
在![]() 催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是
催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是![]() 回答两条
回答两条![]() : ______。
: ______。