题目内容
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系(图中X是H2S):
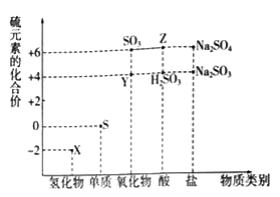
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有________(填化学式);
(2)将X与Y混合,可生成S单质(淡黄色沉淀)。该反应的化学方程式为_______________,其中氧化产物与还原产物的物质的量之比为________;
(3)写出Z的稀溶液与Ba(OH)2溶液发生化学反应的离子方程式___________________________;
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________(填代号);
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______。
【答案】SO2、H2SO3、Na2SO3 ![]() 2:1
2:1 ![]() b +3
b +3
【解析】
S元素的化合价有-2价、0价、+4价、+6价;
(1)具有中间价态的元素既有还原性又有氧化性;
(2)将X为H2S与SO2混合,可生成淡黄色固体,是用二氧化硫的氧化性氧化硫化氢生成淡黄色沉淀S和水,元素化合价降低的物质做氧化剂,元素化合价降低的为还原剂;
(3)Z为硫酸,稀硫酸与Ba(OH)2溶液混合生硫酸钡沉淀和水;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(5)Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,令Cr元素在产物中的化合价为a价,根据电子转移守恒计算a的值。
S元素的化合价有-2价、0价、+4价、+6价;
(1)具有中间价态的元素既有还原性又有氧化性,S元素的化合价有-2价、0价、+4价、+6价,所以0价和+4价S的化合物既有还原性又有氧化性,即SO2,H2SO3、Na2SO3;
(2)将X为H2S与SO2混合,可生成淡黄色固体,是用二氧化硫的氧化性氧化硫化氢生成淡黄色沉淀S和水,发生反应的化学方程式为2H2S+SO2=3S↓+2H2O,反应中硫元素化合价-2价变化为0价,H2S做还原剂,+4价变化为0价,二氧化硫做氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2;
(3)Z为硫酸,稀硫酸与Ba(OH)2溶液混合生硫酸钡沉淀和水,发生化学反应的离子方程式为![]() ;
;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,cd中S的化合价都大于2,b符合题意,故答案为b;
(5)令Cr元素在产物中的化合价为a价,根据电子转移守恒,则24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a),解得a=+3,即Cr元素在还原产物中的化合价为+3。