题目内容
【题目】氮及其化合物在人们的生活经常出现。
(1)汽车尾气中NO生成过程的能量变化示意图如图:
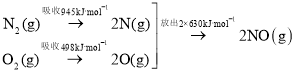
该条件下,![]() 和
和![]() 完全反应生成
完全反应生成![]() ,会___(填“吸收”或“放出”)__kJ能量。
,会___(填“吸收”或“放出”)__kJ能量。
(2)一定温度下,在体积为![]() 的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。
的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。
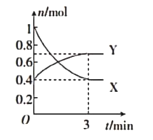
①写出该反应的化学反应方程式:____(用物质的化学式表示)
②在![]() 内,用Y表示的反应速率为____。
内,用Y表示的反应速率为____。
③下列叙述能说明该反应已达到化学平衡状态的是____(填字母)。
a.容器内压强不再发生变化
b.X的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗![]() 的同时生成
的同时生成![]()
④反应达到平衡后,若降低温度,则v(正)____,v(逆)___。(填“增大“减小”或“不变”)。
(3)反应![]() 在四种不同情况下的反应速率分别为:
在四种不同情况下的反应速率分别为:
①![]() ②
②![]()
③![]() ④
④![]()
该反应在四种不同情况下速率由大到小的顺序为(用序号填空)_____。
【答案】吸收 91.5 ![]()
![]() ab 减小 减小 ②>③>①=④
ab 减小 减小 ②>③>①=④
【解析】
根据断键和成键过程中能量的变化计算反应热;根据反应物的浓度变化计算反应速率;根据化学平衡状态的特征分析反应是否达到平衡;根据反应速率与化学计量数间的关系比较反应的快慢。
(1)断键吸收能量为945kJ+498kJ=1443kJ/mol,成键放出能量为2×630kJ=1260kJ/mol,由于吸收的能量大于放出的能量,所该反应为吸热反应,生成1molNO吸收的热量为![]() (1443kJ/mol-1260kJ/mol)=91.5kJ/mol,故答案为:吸收;91.5;
(1443kJ/mol-1260kJ/mol)=91.5kJ/mol,故答案为:吸收;91.5;
(2)①根据图示可知反应物X消耗1mol-0.4mol=0.6mol时,生成Y0.7mol-0.4mol=0.3mol,则根据原子守恒可知该反应为![]() ;
;
②v(Y)=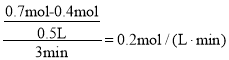 ;
;
③a.该反应为气体体积减小的反应,当容器内压强不再发生变化,说明反应已经达到平衡,故此项正确;
b.X的体积分数不再发生变化,说明反应物的浓度不再变化,说明反应已经达到平衡,故此项正确;
c.根据原子守恒,反应前后原子总数始终不变,所以容器内原子总数不再发生变化不能说明反应已经达到平衡,故此项错误;
d.消耗![]() 的同时生成
的同时生成![]() 都是逆反应的过程,不能说明正反应速率等于逆反应速率,故此项错误,故选ab;
都是逆反应的过程,不能说明正反应速率等于逆反应速率,故此项错误,故选ab;
④温度越高反应越快,所以减低温度时,正逆反应速率都减小,故答案为:减小;减小;
(3)根据反应速率之比等于化学计量数之比计算知:①![]() ②
②![]() ,则
,则![]() ;③
;③![]() ,则
,则![]() ,④
,④![]() ,则
,则![]() ,所以该反应在四种不同情况下速率由大到小的顺序为②>③>①=④。
,所以该反应在四种不同情况下速率由大到小的顺序为②>③>①=④。

 名校课堂系列答案
名校课堂系列答案